Bài 1. Cho 3,33 g kim loại kiềm tác dụng với nước dư thí có 0,48 g H2 thoát ra. Xác định tên kim loại.
Bài 2. Cho 16,2 g kim loại A thuộc nhóm IIA tác dụng với 63,9 g Cl, phản ứng xảy ra vừa đủ.
a) Xác định kim loại A
b) Nếu cho 21,6 g A tác dụng với HCl dư thì thể tích khí bay ra là bao nhiêu?

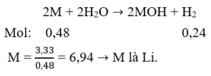
Bài 1:
\(\text{2X+2H2O->2XOH+H2}\)
Ta có : \(\text{nH2=0,48/2=0,24(mol)}\)
=>nX=0,48(mol)
\(\text{MX=3,33/0,48=7}\)
=>X là Liti
Bài 2
\(\text{X+Cl2->XCl2}\)
Ta có :\(\text{nCl2=63,9/71=0,9(mol)}\)
MX=16,2/0,9=18
Xem lại đề nhé
Đặt kim loại kiềm là R (hóa trị n)
PTHH;
R + 2nH2O → R(OH)n + nH2
0,24/n <----------------- 0,24
=> MR = 0,24/n . R = 3,33
⇔ R = 7 (Li)
Vậy R là nguyên tố Liti