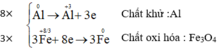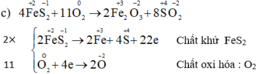Trình bày các bước cân bằng các phản ứng oxi hóa-khử sau bằng phương pháp
thăng bằng electron?
a) KClO3 + NH3 ot⎯⎯→KCl + KNO3 + Cl2 + H2O
b) S + NaOH ot⎯⎯→ Na2SO4 + Na2S + H2O
c) FeI2 + H2SO4 ot⎯⎯→Fe2(SO4)3 + SO2 + I2 + H2O
d) MnO2 + K2MnO4 + H2SO4 ⎯⎯→ MnSO4 + KMnO4 + K2SO4 + H2O
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a) 4NH3 + 5O2 -to-> 4NO + 6H2O
Chất khử: NH3, chất oxh: O2
| \(N^{-3}-5e->N^{+2}\) | x4 |
| \(O_2^0+4e->2O^{-2}\) | x5 |
b) 2H2S + O2 -to-> 2S + 2H2O
Chất khử: H2S, chất oxh: O2
| \(S^{-2}-2e->S^0\) | x2 |
| \(O^0_2+4e->2O^{-2}\) | x1 |
c) 2Al + Fe2O3 -to-> Al2O3 + 2Fe
Chất khử: Al, chất oxh: Fe2O3
| Al0-3e--> Al+3 | x2 |
| Fe2+3 +6e--> 2Fe0 | x1 |
d) Fe2O3 + 3CO -to-> 2Fe + 3CO2
Chất oxh: Fe2O3, chất khử: CO
| Fe2+3 +6e-->2Fe0 | x1 |
| C+2 - 2e --> C+4 | x3 |
e) CuO + CO -to-> Cu + CO2
Chất oxh: CuO, chất khử: CO
| Cu+2 +2e-->Cu0 | x1 |
| C+2 -2e --> C+4 | x1 |

a) KClO3 + 6HCl --> KCl + 3Cl2 + 3H2O
Chất khử: HCl, chất oxh: KClO3
| QT khử | Cl+5 + 6e --> Cl-1 | x1 |
| QT oxh | 2Cl-1 - 2e --> Cl20 | x3 |
b) 2KMnO4 --to--> K2MnO4 + MnO2 + O2
Chất khử: KMnO4, chất oxh: KMnO4
| QT khử | 2Mn+7 + 4e --> Mn+6 + Mn+4 | x1 |
| QT oxh | 2O-2 - 4e --> O20 | x1 |
\(a.QToxh:2\overset{-1}{Cl}\rightarrow Cl_2+2e|\times5\\QTkhử:2\overset{+5}{Cl}+10e\rightarrow \overset{0}{Cl_2}|\times1\)
HCl là chất oxi hóa, KClO3 là chất khử
\(KClO_3+6HCl_{đặc}\rightarrow KCl+3Cl_2+3H_2O\)
\(b.QToxh:2\overset{-2}{O}\rightarrow\overset{0}{O_2}+4e|\times1\\ QTkhử:2\overset{+7}{Mn}+4e\rightarrow\overset{+6}{Mn}+\overset{+4}{Mn}|\times1\)
KMnO4 vừa là chất khử, vừa là chất oxi hóa
\(2KMnO_4-^{t^o}\rightarrow K_2MnO_4+MnO_2+O_2\)

a. 4Mg + 10HNO3 ---> 4Mg(NO3)2 + NH4NO3 + 3H2O
b. 8Na + 5H2SO4 ---> 4Na2SO3 + 5H2S + 4H2O
c. 2FexOy + (3x - 2y)H2SO4 ---> xFe2(SO4)3 + 2ySO2 + (3x - 2y)H2O
d. 2HNO3 + 3H2S ---> 2NO + 3S + 4H2O
e. 3FexOy + (12x - 2y)HNO3 ---> 3xFe(NO3)3 + (3x - 2y)NO + (6x - y)H2O
f. Fe + 6HNO3 ---> Fe(NO3)3 + 3NO2 + 3H2O
g. 4FeS2 + 11O2 ---to---> 2Fe2O3 + 8SO2
h. 2FeO + 4H2SO4 ---> Fe2(SO4)3 + SO2 + 4H2O

b,10FeSO4 + 2KMnO4 + 8H2SO4 → 5Fe2(SO4)3 + K2SO4 + 2MnSO4+ 8H2O
e,3CI2 +6KOH → 5KCl + KClO3 + 3H2O

Bài 2:
\(m_{HF}=\dfrac{2,5.40\%}{100\%}=1(kg)\\ \Rightarrow n_{HF}=\dfrac{1}{20}=0,05(kmol)\\ PTHH:CaF+H_2SO_4\to CaSO_4+2HF\\ \Rightarrow n_{CaF}=0,025(kmol)\\ \Rightarrow m_{CaF}=0,025.78=1,95(kg)\)
Bài 3:
\(a,\) Đặt \(\begin{cases} n_{Fe}=x(mol)\\ n_{Al}=y(mol) \end{cases} \)
\(n_{H_2}=\dfrac{8,96}{22,4}=0,4(mol)\\ PTHH:2Al+6HCl\to 2AlCl_3+3H_2\\ Fe+2HCl\to FeCl_2+H_2\\ \Rightarrow \begin{cases} 56x+27y=11\\ x+1,5y=0,4 \end{cases} \Rightarrow \begin{cases} x=0,1(mol)\\ y=0,2(mol) \end{cases}\\ \Rightarrow \begin{cases} \%_{Fe}=\dfrac{0,1.56}{11}.100\%=50,91\%\\ \%_{Al}=100\%-50,91\%=49,09\% \end{cases} \)
\(b,\Sigma n_{HCl}=3n_{Al}+2n_{Fe}=0,2+0,6=0,7(mol)\\ \Rightarrow V_{dd_{HCl}}=\dfrac{0,7}{2}=0,35(l)\)