1. Hãy biểu diễn dung dịch H2SO4 đặc 98% ( d= 1,84g/ml) theo nồng độ mol.
2. Hãy lập biểu thức liên hệ giữa nồng độ phần trăm, khối lượng riêng và nồng độ mol
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.



1/ \(n_A=\dfrac{m_{dd}.C\%}{100.M_A}\)
2/ \(V_{dd}=\dfrac{m}{D}\)
=> \(C_M=\dfrac{n}{V}=\dfrac{n.D}{m}\)


Lấy V lít hay 1000V ml dung dịch
=> Khối lượng dung dịch là: mdd = 100V. D
=> Khối lượng chất tan là:\( {m_{c\tan }} = {{{m_{dd}}} \over {100\% }}.C\% = {{1000V.D} \over {100\% }}.C\% = 10V.D.C\% \)
=> Số mol của chất tan là: \({n_{c\tan }} = {{{m_{c\tan }}} \over M} = {{10V.D.C\% } \over M}\)
Mà ta có:
\(\eqalign{ & {C_M} = {{{n_{c\tan }}} \over V} = {{{{10V.D.C\% } \over M}} \over V} \cr & \Rightarrow {C_M} = {{10.D.C\% } \over M}\,\,\,\,\,\,(dpcm) \cr} \)

* Số mol của H 2 S O 4 cần để pha chế 500ml dung dịch H 2 S O 4 1M:
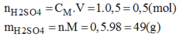
* Khối lượng H 2 S O 4 98% có chứa 49g H 2 S O 4 :
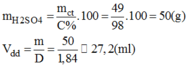
* Cách pha chế: Đổ khoảng 400ml nước cất vào cốc có chia độ có dung tích khoảng 1lit. Rót từ từ 27,2ml H 2 S O 4 98% vào cốc khuấy đều. Sau đó thêm dần dần nước cất vào cốc cho đủ 500ml. ta pha chế được 500ml dung dịch H 2 S O 4 1M.

1)
- nồng độ dung dịch :
+ nồng độ phần trăm
+ nồng độ mol
- nồng độ phần trăm là cho biết số gam chất tan có trong 100 gam dd
Khối lượng chất tan là mct
Khối lượng dd là mdd
Nồng độ phần trăm là C%
=> C% = \(\frac{m_{ct}.100}{m_{dd}}\)
- Nồng độ mol của dd là cho biết số mol chất tan cú trong một lit dd
CM =\(\frac{n}{C_v}\)
2.
công thức liên hệ là :
C% = \(\frac{S}{S+100}.100\%\)

Nồng độ phần trăm :
C% = \(\dfrac{m_{ct}}{m_{dd}}.100\%\)
Khối lượng chất tan = mdd - m dung môi
Khối lượng dung dịch = mctan + mdung môi
Nồng độ mol CM = n/v