Để thu được 89,03 tấn H2SO4 người ta sử dụng 68 tấn quặng pirit chứa 50%S,còn lại là tạp chất. Hỏi hiệu suất của quá trình sản xuất axit là bao nhiêu?
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Đáp án C.
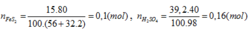
FeS2→ 2H2SO4
0,08 ← 0,16 (mol)
H% = 0,08.100/0,1= 80%

ôi t làm nhầm....kq là
3,8 tấn ( cân bằng thêm 2 vào h2so4 là okok)
FeS2 ==> H2SO4
120g 98g
2,85( vì 5% tạp chất) 2,3275 (tấn)
vì H=80% ====> m H2SO4=1,3965( tấn). nhưng có C% H2SO4= 98%
VẬY mdd H2S04 là 1,425 tấn

Đáp án A
Để đơn giản về tính toán thì ta xem đơn vị tấn như gam.

Quặng này chứa 10% tạp chất trơ tức
FeS2 chiếm 90%.
Vậy khối lượng quặng pirit sắt cần:
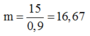

Đáp án A
Để đơn giản về tính toán thì ta xem đơn vị tấn như gam.


Khối lượng lưu huỳnh chứa trong 80 tấn quặng:
m S = 80x40/100 = 32 tấn
Điều chế H 2 SO 4 theo sơ đồ sau
S → SO 2 → SO 3 → H 2 SO 4
Ta thấy: Cứ 32g S thì sản xuất được 98g H 2 SO 4
⇒ m H 2 SO 4 = 32x98/32 = 98 tấn
Hiệu ứng phản ứng: H = 73,5/98 x 100 = 75%



mS = 68*50/100=34 tấn
Sơ đồ sản xuất :
S ---------------------> H2SO4
32_________________98
34_________________x
x = 34*98/32=104.125 tấn
H = 89.03/104.125*100% = 85.5%