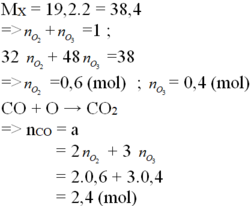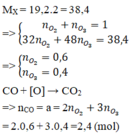Hỗn hợp khí A gồm O2 và O3,tỉ khối của A so với H2 bằng 20. Hỗn hợp hơi B gồm CH4 và CH3COOH. Tính số mol hỗn hợp A cần dùng để đốt cháy hoàn toàn 1 mol hỗn hợp hơi B, biết sản phẩm cháy gồm CO2 và H2O.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Đáp án B
Nhận thấy :
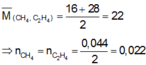
Quy đổi O2 và O3 thành O. Theo bảo toàn electron và bảo toàn khối lượng, ta có :
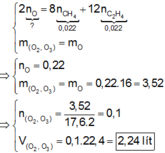

PTHH của các phản ứng :
2CO + O 2 → 2C O 2 (1)
3CO + O 3 → 3C O 2 (2)
Trong 1 mol hỗn hợp khí A có 0,6 mol O 3 và 0,4 mol O 2
Theo (1): 0,6 mol O 2 đốt cháy được 1,2 mol CO.
Theo (2) : 0,4 mol O 3 đốt cháy được 1,2 mol CO.
Kết luận : 1 mol hỗn hợp khí A đốt cháy được 2,4 mol khí CO.

Đặt a,b lần lượt là số mol của O2, O3 trong hh
\(M_{hh}=20.2=40\left(\dfrac{g}{mol}\right)\\ M_{hh}=\dfrac{32a+48b}{a+b}=40\\ \Leftrightarrow40a+40b=32a+48b\\ \Leftrightarrow8a=8b\\ \Leftrightarrow\dfrac{a}{b}=\dfrac{1}{1}\)
=> tỉ lệ số mol trong hh trên giữa O2 và O3 là 1:1
\(CH_4+2O_2\rightarrow\left(t^o\right)CO_2+2H_2O\\ C_2H_4O_2+2O_2\rightarrow\left(t^o\right)2CO_2+2H_2O\\ n_{O_2}=2.\left(n_{CH_4}+n_{C_2H_4O_2}\right)=2.\left(1+1\right)=4\left(mol\right)\\ \Rightarrow n_X=n_{O_2}.2=4.2=8\left(mol\right)\)
Em nghĩ chưa đúng đâu chị, tại căn bản là hỗn hợp khí có 2 khí oxi và ozon thì mình không nên giả sử ạ!

MA = 22.2 = 44.
Đặt công thức phân tử trung bình của (O2 và O3) là On
=>16.n =44
=> n =2,75
MB =11,5.2 =23 .
Đặt công thức phân tử trung bình của (CH4 và C2H6) là \(C_mH_{2m+2}\)
=>14m +2 =23
=> m =1,5
Phương trình cháy
\(C_{1,5}H_5+2O_{2,75}\rightarrow1,5CO_2+2,5H_2O\)
0,2(mol)-----> 0,4(mol)
VA =0,4.22,4 = 8,96 (lít)
MA = 22.2 = 44.Đặt công thức phân tử trung bình của (O2 và O3) là On =>16.n =44
=> n =2,75
MB =11,5.2 =23 . Đặt công thức phân tử trung bình của (CH4 và C2H6) là
CmH2m+2 =>14m +2 =23 => m =1,5
Phương trình cháy
C1,5H5 + 2O2,75 -to> 1,5CO2 + 2,5H2O
0,2(mol)-----> 0,4(mol)
VA =0,4.22,4 = 8,96 (lít)

Chọn nCO2 = 6 , nH2O = 7
Hỗn hợp Y gồm nO2 = a mol, nO3 = b mol
X + Y → CO2 + H2O
Áp dụng ĐLBT nguyên tố O: 2a + 3b = 6.2 + 7
mY = 32a + 48b = 19.2 (a+b)
=> a = 5 và b = 3
=> nX = 1/2 nY = 4 mol
=> mX = 6.44 + 7.18 - 32.5 - 48.3 = 83 gam
<=> MX = \(\dfrac{m_X}{n_X}\)= 20,75 gam/mol
<=> d\(\dfrac{X}{H_2}\)= 20,75:2 = 10,375