Trộn 150 ml dung dịch KOH 0,2M với 150 ml dung dịch HCl 0,18M thu được dd A. Tính pH của dung dịch A?
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


a, \(n_{NaOH}=0,15.0,2=0,03\left(mol\right)=n_{Na^+}=n_{OH^-}\)
\(n_{KOH}=0,15.0,2=0,03\left(mol\right)=n_{K^+}=n_{OH^-}\)
⇒ ΣnOH- = 0,03 + 0,03 = 0,06 (mol)
\(n_{HCl}=0,25.0,4=0,1\left(mol\right)=n_{H^+}=n_{Cl^-}\)
\(H^++OH^-\rightarrow H_2O\)
0,06____0,06 (mol) ⇒ nH+ dư = 0,1 - 0,06 = 0,04 (mol)
\(\left[Na^+\right]=\left[K^+\right]=\dfrac{0,03}{0,15+0,25}=0,075\left(M\right)\)
\(\left[H^+\right]=\dfrac{0,04}{0,15+0,25}=0,1\left(M\right)\)
\(\left[Cl^-\right]=\dfrac{0,1}{0,15+0,25}=0,25\left(M\right)\)
b, pH = -log[H+] = 1

Chọn D
Trộn 3 dung dịch với thể tích bằng nhau thu được 150 ml dung dịch X → mỗi dung dịch lấy 50ml.
→ n H + = 0,05.0,2 + 0,05.2.0,1 + 0,05.0,08 = 0,024 mol.
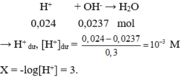

Ví dụ 5 :
n KOH = 0,02.0,35 = 0,007(mol)
n HCl = 0,08.0,1 = 0,008(mol)
$KOH + HCl \to KCl + H_2O$
n HCl pư = n KOH = 0,007(mol)
=> n HCl dư = 0,008 - 0,007 = 0,001(mol)
V dd = 0,02 + 0,08 = 0,1(mol)
=> [H+ ] = CM HCl dư = 0,001/0,1 = 0,01M
=> pH = -log(0,01) = 2

\(n_{HCl}=0,1\cdot0,25=0,025mol\)
\(n_{H_2SO_4}=0,05\cdot0,15=0,0075mol\)
\(\Rightarrow n_{H^+}=n_{HCl}+2n_{H_2SO_4}=0,04mol\)
\(\Rightarrow C=\dfrac{n}{V}=\dfrac{0,04}{0,25+0,15}=0,1M\)
\(\Rightarrow pH=-log\left(0,1\right)=1\)
Chọn A.

Chọn đáp án A
Phản ứng: KOH + HCl → KCl + H2O
Có nKOH = 0,02 mol; nHCl = 0,01 mol
⇒ sau phản ứng thu được 200 ml dung dịch X gồm 0,01 mol KCl
và 0,01 mol KOH → dung dịch X có môi trường bazơ.
pH = 14 + log([OH−]) = 14 + log(0,01 ÷ 0,2) = 12,7 → chọn đáp án A.
\(n_{KOH}=0,03mol\)
\(n_{HCl}=0,027mol\)
\(OH^-+H^+\rightarrow H_2O\)
bđ 0,3 0,027 0
pư 0,027 0,027 0,027
kt 0,273 0 0,027
\(\left[OH\right]^-_{dư}=\dfrac{0.273}{0,15+0,15}=0,91\)
\(\Rightarrow pH_A=-log\left(\dfrac{10^{-14}}{0,91}\right)=13,96\)