Cho 4,48 lít(đktc)khí SO2 tác dụng hết với 250ml dung dịch Ba(OH)2 thu được muối sunfit và nước a)Viết phương trình hóa học b)Tính nồng độ dung dịch Ba(OH)2 đã phản ứng c)Tính khối lượng muối thu được sau phản ứng
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


a)
PTHH : \(SO_2+Ca\left(OH\right)_2\rightarrow CáO_4+H_2O\)
b)
Ta có :
\(n_{SO_2}=\frac{0,224}{22,4}=0,01\left(mol\right)\)
\(n_{Ca\left(OH\right)_2}=0,01\times1,4=0,014\)
Theo ptpư : \(n_{SO_2}=n_{Ca\left(OH\right)_2}=n_{CaSO_3}=n_{H_2O}\)
Vậy nCa(OH)2 ( dư ) = \(n_{Ca\left(OH\right)_2\left(bđ\right)}-n_{Ca\left(OH\right)_2\left(pư\right)}\)
\(=0,014-0,001=0,004\left(mol\right)\)

Số mol của khí cacbonic ở dktc
nCO2 = \(\dfrac{V_{CO2}}{22,4}=\dfrac{3,36}{22,4}=0,15\left(mol\right)\)
a) CO2 + Ba(OH)2 → BaCO3 + H2O\(|\)
1 1 1 1
0,15 0,15 0,15
b) Số mol của bari cacbonat
nBaCO3 = \(\dfrac{0,15.1}{1}=0,15\left(mol\right)\)
Khối lượng của bari cacbonat
mBaCO3 = nBaCO3 . MBaCO3
= 0,15 . 197
= 29,55 (g)
Số mol của dung dịch bari hidroxit
nBa(OH)2 = \(\dfrac{0,15.1}{1}=0,15\left(mol\right)\)
300ml = 0,3l
Nồng độ mol của dung dịch bari hidroxit
CMBa(OH)2 = \(\dfrac{n}{V}=\dfrac{0,15}{0,3}=0,5\left(M\right)\)
Chúc bạn học tốt

$n_{SO_2} = \dfrac{3,7185}{22,4} = 0,166(mol)$
\(SO_2+Ba\left(OH\right)_2\text{→}BaSO_3+H_2O\)
0,166 0,166 0,166 (mol)
$C_{M_{Ba(OH)_2}} = \dfrac{0,166}{0,3} = 0,553M$
$m_{BaSO_3} = 0,166.217 = 36,022(gam)$

\(a.n_{CO_2}=\dfrac{5,6}{22,4}=0,25\left(mol\right)\\ a.Ca\left(OH\right)_2+CO_2\rightarrow CaCO_3+H_2O\\ 0,25.......0,25............0,25..........0,25\left(mol\right)\\ C_{MddCa\left(OH\right)_2}=\dfrac{0,25}{0,1}=2,5\left(M\right)\\ b.m_{\downarrow}=m_{CaCO_3}=100.0,25=25\left(g\right)\)

2.
a, \(n_{HCl}=0,2.3,5=0,7\left(mol\right)\)
PTHH: CuO + 2HCl → CuCl2 + H2O
Mol: x 2x
PTHH: Fe2O3 + 6HCl → 2FeCl3 + 3H2O
Mol: y 6y
Ta có: \(\left\{{}\begin{matrix}80x+160y=20\\2x+6y=0,7\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}x=0,05\\y=0,1\end{matrix}\right.\)
b, \(m_{CuO}=0,05.80=4\left(g\right);m_{Fe_2O_3}=20-4=16\left(g\right)\)
c,
PTHH: CuO + 2HCl → CuCl2 + H2O
Mol: 0,05 0,05
PTHH: Fe2O3 + 6HCl → 2FeCl3 + 3H2O
Mol: 0,1 0,2
\(m_{CuCl_2}=0,05.135=6,75\left(g\right)\)
\(m_{FeCl_3}=0,1.162,5=16,25\left(g\right)\)
1.
a, \(n_{CO_2}=\dfrac{2,24}{22,4}=0,1\left(mol\right)\)
PTHH: CO2 + Ba(OH)2 → BaCO3 + H2O
Mol: 0,1 0,1 0,1
b, \(C_{M_{ddBa\left(OH\right)_2}}=\dfrac{0,1}{0,2}=0,5M\)
c, \(m_{BaCO_3}=0,1.197=19,7\left(g\right)\)
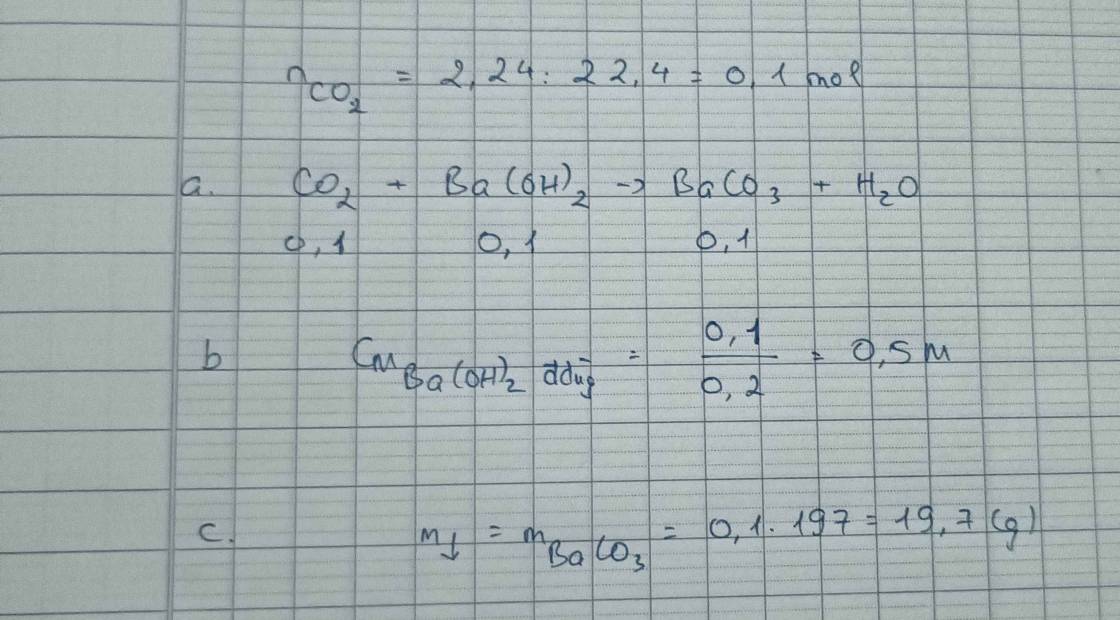
SO2+Ba(OH)2->BaSO3+H2O
0,2-----0,2---------0,2--------0,2
n SO2=4,48\22,4=0,2 mol
=>Cm=0,2\0,25=0,8M
=>m BaSO3=0,2.217=43,4g