Hoà tan hoàn toàn 33,6(g) hỗn hợp gồm FeO, Cứ cần dùng V (lít) dung dịch H2SO4 đặc 11,7M thoát ra 8,96 (lít) (đktc) khi:
a) Tính thành phần phần trăm m FeO
b) Tìm V
c) Tính khối lượng các chất tan có trong dung dịch sau phản ứng
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Quy đổi hỗn hợp X thành Fe (a mol) và O (b mol)
Các quá trình nhường và nhận electron:
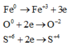
Theo định luật bảo toàn khối lượng ta có: 56a + 16b = 49,6 (1)
Theo định luật bảo toàn electron ta có: 0,4.2 + 2b = 3a (2)
(1) và (2) => a = 0,7; b = 0,65 (mol)
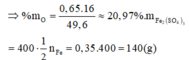
Đáp án A

Coi X gồm Fe và O.
Ta có: 56nFe + 16nO = 49,6 (1)
\(n_{SO_2}=\dfrac{8,96}{22,4}=0,4\left(mol\right)\)
BT e, có: 3nFe - 2nO = 2nSO2 = 0,8 (2)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}n_{Fe}=0,7\left(mol\right)\\n_O=0,65\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow\%m_O=\dfrac{0,65.16}{49,6}.100\%\approx20,97\%\)
Muối thu được là Fe2(SO4)3
BTNT Fe, có: \(n_{Fe_2\left(SO_4\right)_3}=\dfrac{1}{2}n_{Fe}=0,35\left(mol\right)\)
\(\Rightarrow m_{Fe_2\left(SO_4\right)_3}=0,35.400=140\left(g\right)\)

2Al +6HCl-> 2AlCl3+3H2
0,6--------------------------0,9
Al2O3+6HCl-> 2AlCl3+3H2O
n H2=0,9 mol
=>m Al=0,6.27=16,2g
=>%mAl=\(\dfrac{16,2}{36,6}100\)=44,26%
=>%m Al2O3=55,74%
\(n_{H_2}=\dfrac{20,16}{22,4}=0,9mol\)
\(2Al+6HCl\rightarrow2AlCl_3+3H_2\)
0,6 0,9
\(m_{Al}=0,6\cdot27=16,2g\)
\(\%m_{Al}=\dfrac{16,2}{36,6}\cdot100\%=44,26\%\)
\(\%m_{Al_2O_3}=100\%-44,26\%=55,73\%\)

\(n_{H_2}=\dfrac{20,16}{22,4}=0,9mol\)
\(2Al+6HCl\rightarrow2AlCl_3+3H_2\)
0,6 0,9 ( mol )
( \(Al_2O_3+HCl\) không giải phóng \(H_2\) )
\(\rightarrow m_{Al}=0,6.27=16,2g\)
\(\rightarrow\left\{{}\begin{matrix}\%m_{Al}=\dfrac{16,2}{36,6}.100=44,26\%\\\%m_{Al_2O_3}=100\%-44,26\%=55,74\%\end{matrix}\right.\)

C32:
a, \(n_C=\dfrac{2,4}{12}=0,2\left(mol\right)\)
PT: \(C+O_2\underrightarrow{t^o}CO_2\)
Theo PT: \(n_{CO_2}=n_C=0,2\left(mol\right)\Rightarrow V_{CO_2}=0,2.22,4=4,48\left(l\right)\)
b, \(n_{NaOH}=0,3.1=0,3\left(mol\right)\)
\(\Rightarrow\dfrac{n_{NaOH}}{n_{CO_2}}=1,5\) → Pư tạo NaHCO3 và Na2CO3
PT: \(CO_2+NaOH\rightarrow NaHCO_3\)
\(CO_2+2NaOH\rightarrow Na_2CO_3+H_2O\)
Ta có: \(\left\{{}\begin{matrix}n_{CO_2}=n_{NaHCO_3}+n_{Na_2CO_3}=0,2\\n_{NaOH}=n_{NaHCO_3}+2n_{Na_2CO_3}=0,3\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}n_{NaHCO_3}=0,1\left(mol\right)\\n_{Na_2CO_3}=0,1\left(mol\right)\end{matrix}\right.\)
⇒ mNaHCO3 = 0,1.84 = 8,4 (g)
mNa2CO3 = 0,1.106 = 10,6 (g)
c, \(C_{M_{NaHCO_3}}=C_{M_{Na_2CO_3}}=\dfrac{0,1}{0,3}=\dfrac{1}{3}\left(M\right)\)
Lần sau bạn đăng tách câu hỏi ra nhé.
C31:
a, \(Zn+2HCl\rightarrow ZnCl_2+H_2\)
\(ZnO+2HCl\rightarrow ZnCl_2+H_2O\)
b, \(n_{H_2}=\dfrac{2,24}{22,4}=0,1\left(mol\right)\)
Theo PT: \(n_{Zn}=n_{H_2}=0,1\left(mol\right)\)
\(\Rightarrow\left\{{}\begin{matrix}\%m_{Zn}=\dfrac{0,1.65}{14,6}.100\%\approx44,52\%\\\%m_{ZnO}\approx55,48\%\end{matrix}\right.\)
c, \(n_{ZnO}=\dfrac{14,6-0,1.65}{81}=0,1\left(mol\right)\)
Theo PT: \(n_{HCl}=2n_{Zn}+2n_{ZnO}=0,4\left(mol\right)\)
\(\Rightarrow m_{ddHCl}=\dfrac{0,4.36,5}{10\%}=146\left(g\right)\)

PTHH: \(Zn+2HCl\rightarrow ZnCl_2+H_2\uparrow\)
\(Al_2O_3+6HCl\rightarrow2AlCl_3+3H_2O\)
a) Ta có: \(n_{H_2}=\dfrac{8,96}{22,4}=0,4\left(mol\right)=n_{Zn}\)
\(\Rightarrow\%m_{Zn}=\dfrac{0,4\cdot65}{36,2}\cdot100\%\approx71,23\%\) \(\Rightarrow\%m_{Al_2O_3}=28,77\%\)
c) Ta có: \(n_{Al_2O_3}=\dfrac{36,2-0,4\cdot65}{102}=0,1\left(mol\right)\)
Theo PTHH: \(n_{HCl}=2n_{Zn}+6n_{Al_2O_3}=1,4\left(mol\right)\)
\(\Rightarrow m_{ddHCl}=\dfrac{1,4\cdot36,5}{10\%}=511\left(g\right)\) \(\Rightarrow V_{ddHCl}=\dfrac{511}{1,1}\approx464,5\left(ml\right)=0,4645\left(l\right)\)
c) Theo PTHH: \(\left\{{}\begin{matrix}n_{ZnCl_2}=0,4\left(mol\right)\\n_{AlCl_3}=0,2\left(mol\right)\end{matrix}\right.\) \(\Rightarrow\left\{{}\begin{matrix}C_{M_{ZnCl_2}}=\dfrac{0,4}{0,4645}\approx0,86\left(M\right)\\C_{M_{AlCl_3}}=\dfrac{0,2}{0,4645}\approx0,43\left(M\right)\end{matrix}\right.\)