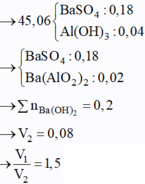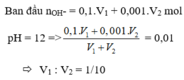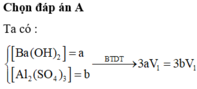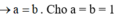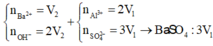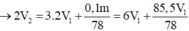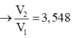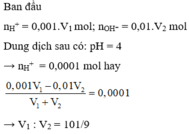Câu 1 : Có V1 ml dung dịch H2SO4 pH = 2 . Trộn thêm V2 , ml H2O vào dung dịch trên được ( V1+ V2 ) ml dung dịch mới có pH = 3 . Vậy tỉ lệ V1: V2, có giá trị bằng:
—kết quả: 1:9
Câu 2 : Cho 29 gam hỗn hợp gồm Al ; Fe ; Cu tác dụng hết với HNO3, thu được 0.448 lít khí NO ( đktc ) Tính khối lượng muối khan thu được sau phản ứng
Câu 3 : Nung 1 lượng Cu(NO3)2 sau 1 thời gian dừng lại , để nguội rồi cân thấy khối lượng giảm 2.16 g . Tổng thể tích các khí thu được là ? ( Cu = 64 , N = 14 , 0 = 16 )
Câu 4 : Nhiệt phân hoàn toàn m gam AgNO3, sau phản ứng nhận thấy khối lượng chất rắn giảm 0.62 gam . Giá trị của m là (Ag = 108, N = 14, O = 16 )
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Chọn đáp án B
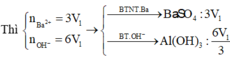
Xét thí nghiệm 1: 3Ba(OH)2 + Al2(SO4)3 → 3BaSO4 + 2Al(OH)3.
Giả sử
![]()
Phản ứng vừa đủ ⇒ n B a ( O H ) 2 = 3 V 1
![]()
![]()
⇒ 0 , 9 m = 769 , 5 V 1 g a m
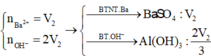
s TH1: Ba(OH)2 thiếu. n B a ( O H ) 2 = V 2 mol
![]()
![]()
![]()
s TH2: Ba(OH)2 dư, hòa tan 1 phần Al(OH)3. Khi đó:
3Ba(OH)2 + Al2(SO4)3 → 3BaSO4 + 2Al(OH)3 (1)
Ba(OH)2 + 2Al(OH)3 → Ba(AlO2)2 + 4H2O (2)
Từ (1)
![]()
![]()
![]()
![]()
![]()

Sau phản ứng, \(V_{dd}= V_1 + V_2(lít)\)
Ta có : [H+] = 10-3 ⇒ \(n_{H_2SO_4} = 5.10^{-4}V_1(mol)\)
Lại có: \(n_{NaOH} = V_2.\dfrac{10^{-14}}{10^{-12}} = 0,01V_2(mol)\)
pH = 4 < 7 Chứng tỏ axit dư
2NaOH + H2SO4 → Na2SO4 + 2H2O
0,01V2.......5.10-3V2..................................(mol)
Suy ra : \(\dfrac{5.10^{-4}V_1-5.10^{-3}V_2}{V_1+V_2}.2 = 10^{-4}\\ \Rightarrow \dfrac{V_1}{V_2} = \dfrac{101}{9}\)
Đáp án B

Định hướng tư duy giải
Ta có:
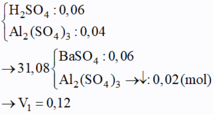
Thêm tiếp Ba(OH)2 kết tủa bị tan 1 phần