K
Khách
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.
Các câu hỏi dưới đây có thể giống với câu hỏi trên

26 tháng 1 2018
Đáp án A
nH+ = 0,04V1 (mol); nOH-= 0,035V2 (mol)
H++ OH- → H2O
Dung dịch sau phản ứng có pH = 2 nên axit dư
nH+ dư = 0,04V1- 0,035V2
[H+]dư = nH+ dư/ Vdd = (0,04V1- 0,035V2)/(V1+ V2) = 10-2
Suy ra V1/V2 = 3/2

H
19 tháng 6 2021
Ví dụ 5 :
n KOH = 0,02.0,35 = 0,007(mol)
n HCl = 0,08.0,1 = 0,008(mol)
$KOH + HCl \to KCl + H_2O$
n HCl pư = n KOH = 0,007(mol)
=> n HCl dư = 0,008 - 0,007 = 0,001(mol)
V dd = 0,02 + 0,08 = 0,1(mol)
=> [H+ ] = CM HCl dư = 0,001/0,1 = 0,01M
=> pH = -log(0,01) = 2
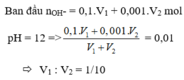
\(n_{OH^-}=0,12V_1\)
\(n_{H^+}=0,17V_2\)
\(n_{OH^-dư}=\left(V_1+V_2\right).10^{-1}\)
Ta có:
\(n_{OH^-dư}+n_{H^+}=n_{OH^-}\)
\(\Leftrightarrow\left(V_1+V_2\right).10^{-1}=0,12V_1\)
\(\Leftrightarrow0,1V_1=0,02V_2\)
\(\Rightarrow\dfrac{V_1}{V_2}=\dfrac{1}{5}\)