cứu emmm
Câu 58. Đun nóng hỗn hợp gồm 6(g) rượu etylic và 6(g) axit axetic có H2SO4 đặc, Nếu hiệu suất phản ứng đạt 75% thì khối lượng este tạo thành là?
A. 7,2(g) B. 8,6(g) C. 6,6(g) D. 8,8(g)
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

$PTHH : CH_3COOH + C_2H_5OH \buildrel{{H_2SO_4 đ,t^o}}\over\rightleftharpoons CH_3COOC_2H_5 + H_2O \\ n_{CH_3COOH} = \dfrac{3}{60} = 0,05(mol) \\ n_{C_2H_5OH} = \dfrac{2,5}{46} = 0,054(mol) \\ Ta có : n_{C_2H_5OH} > n_{CH_3COOH} \to C_2H_5OH dư \\ n_{ CH_3COOC_2H_5 } = n_{CH_3COOH} = 0,05(mol) \\ m_{este} = 0,05.88 = 4,4(gam) \\ m_{este(tt)} = 4,4.0,9 = 3,96(gam)$


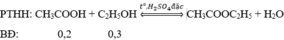
(0,2/1 < 0,3/1 nên hiệu suất tính theo axit)
Pư: 0,2h → 0,2h → 0,2h
Sau: 0,2 - 0,2h 0,3-0,2h 0,2h
=> m este = mCH3COOC2H5 = 14,08 gam
=> 0,2h.88 = 14,08 => h = 0,8 = 80%
Đáp án cần chọn là: D

nC2H5OH = 8.05/46 = 0.175 (mol)
nCH3COOH = 36/60 = 0.6 (mol)
nCH3COOC2H5 = 12.32/88 = 0.14 (mol)
C2H5OH + CH3COOH <-H2SO4đ,t0-> CH3COOC2H5 + H2O
1.......................1
0.175................0.6
LTL : 0.175/1 < 0.6/1
=> CH3COOH dư
mCH3COOH (dư) = ( 0.6 - 0.175) * 60 = 25.5 (g)
nCH3COOC2H5 = nC2H5OH = 0.175 (mol)
H% = 0.14/0.175 * 100% = 80%

Chọn đáp án C
Trong điều kiện đun nóng, xúc tác H2SO4 đặc, xảy ra phản ứng:
CH3COOH + C2H5OH ⇄ CH3COOC2H5.
n C H 3 C O O H = 0 , 2 m o l ; n C 2 H 5 O H = 0 , 1 m o l
→ Số mol este tính theo C2H5OH.
n C H 3 C O O C 2 H 5 = n C 2 H 5 O H . H %
= 0,1.0,75 = 0,075 mol
⇒ m C H 3 C O O C 2 H 5 = 6 , 60 g a m

Đáp án B
, naxit = 0,1 mol < nancol = 0,13 mol
=> Tính hiệu suất theo axit
=> nCH3COOC2H5 = naxit.H% = 0,08 mol
=> meste = 7,04g
=>B