Trong tự nhiên đồng có hai đồng vị 63Cu và 65Cu trong đó 65Cu chiếm khoảng 27% về khối lượng . Phần trăm khối lượng của 63Cu trong Cu2S là ? biết S = 32
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Đồng vị \(^{65}Cu\) chiếm 27% về số nguyên tử.
\(\Rightarrow\)Đồng vị \(^{63}Cu\) chiếm 73% về số nguyên tử.
Số nguyên tử khối:
\(\overline{A_{Cu}}=\dfrac{65\cdot27+63\cdot73}{100}=63,54\)
\(\%m_{^{63}Cu}=\dfrac{63\cdot0,73}{63,54+2\cdot35,5}\cdot100\%=34,18\%\)

Đáp án D
Phần trăm nguyên tử 63Cu trong tự nhiên là: %63Cu = 100 - 27 = 73%.
Khối lượng nguyên tử trung bình của Cu là:
MCu = 65 x 0,27 + 63 x 0,73 = 63,54
Phần trăm của 63Cu trong CuSO4.5H2O là
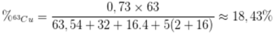

Đáp án B
Giả sử % nguyên tử 65Cu và 63Cu trong tự nhiên lần lượt là x, y.
Ta có hpt:
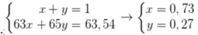
Phần trăm khối lượng của 63Cu trong Cu2O là
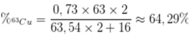

Gọi x là số phần trăm của đồng vị 63Cu
Suy ra phần trăm đồng vị 65Cu là 100 – x
M = [63.x + 65(100 – x)]/100 = 63,546
<=> x = 72,7%
Từ đây dễ dàng tìm được % của 63Cu trong tinh thể CuSO4.5H2O là 18,43%
=> Đáp án D