Hãy tìm khối lượng của những đơn chất và hợp chất sau:
CO2, H2O, O2, N2, H2, NaCl để cùng có số phân tử bằng nhau là 0.6 x 1023
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Cứ 1 mol chất là lượng chất có chứa 6. 10 23 phân tử (nguyên tử).
Vậy cứ 0,6. 10 23 phân tử các chất là số phân tử có trong 0,1 mol chất.
Khối lượng các chất là:
m C O 2 = n C O 2 . M C O 2 = 0,1.44 = 4,4(g)
m H 2 O = n H 2 O . M H 2 O = 0,1.18 = 1,8(g)
m O 2 = n O 2 . M O 2 = 0,1.32 = 3,2(g)
m H 2 = n H 2 . M H 2 = 0,1.2 = 0,2(g)
m N a C l = n N a C l . M N a C l = 0,1.58,5 = 5,85(g)

câu 1:
\(PTK\) của \(H_2SO_4=2.1+1.32+4.16=98\left(đvC\right)\)
\(PTK\) của \(Ba\left(OH\right)_2=1.137+\left(1.16+1.1\right).2=171\left(đvC\right)\)
\(PTK\) của \(Al_2\left(SO_4\right)_3\)\(=2.27+\left(1.32+4.16\right).3=342\left(đvC\right)\)
\(PTK\) của \(Fe_3O_4=3.56+4.16=232\left(đvC\right)\)

24.
10
23
phân tử
H
2
O
=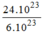 = 4(mol) phân tử
H
2
O
= 4(mol) phân tử
H
2
O
1,44.
10
23
phân tử
C
O
2
=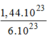 = 0,24(mol) phân tử
C
O
2
.
= 0,24(mol) phân tử
C
O
2
.
0,66.
10
23
phân tử
C
12
H
22
O
11
=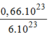 = 0,11(mol) phân tử
C
12
H
22
O
11
.
= 0,11(mol) phân tử
C
12
H
22
O
11
.

a) Số phân tử khí trong mỗi bình bằng nhau vì có thể tích bằng nhau nên tương ứng số mol các chất khí bằng nhau
b) Số mol trong các chất ở mỗi bình bằng nhau vì thể tích các chất bằng nhau và đều được đo ở cùng điều kiện nhiệt độ và áp suất
c) khối lượng chất khí trong mỗi bình không bằng nhau vì khối lượng phân tử của mỗi chất không giống nhau
\(m_{CO_2}>m_{O_2}>m_{N_2}>m_{H_2}\)
a) Số phân tử của mỗi khí trong bình đều bằng nhau do các bình có thể tích bằng nhau
b) Số mol chất trong mỗi bình bằng nhau do số phân tử của mỗi chất bằng nhau (câu a)
c) Không bằng nhau do phân tử khối của chúng khác nhau
PTK của H2 = 2 đvC => khối lượng nhỏ nhất
_________O2 = 32 đvC
_________N2 = 28 đvC
_________CO2 = 44 đvC =>khối lượng lớn nhất

`#3107.101107`
PTK của phân tử khí N2 là:
\(14\cdot2=28\left(\text{amu}\right)\)
Tương tự các chất còn lại:
`@` H2O
\(1\cdot2+16=2+16=18\left(\text{amu}\right)\)
`@` CaO
`40 + 16 = 56 (\text{amu})`
`@` Fe: `56` amu
______
- Khi hình thành hợp chất NaCl, các nguyên tử đã có sự nhường nhận e như sau:
+ Ng tử Na nhường 1 e ở lớp ngoài cùng cho nguyên tử Cl để tạo thành ion dương Na+ và có vỏ bền vững giống khí hiếm Neon.
+ Ng tử Cl nhận 1 e vào lớp ngoài cùng từ nguyên tử Na để tạo thành ion âm Cl- và có vỏ bền vững giống khí hiếm Argon.
Hai ion mang điện tích ngược dấu, hút nhau hình thành liên kết ion trong hợp chất NaCl.
Vậy, hc NaCl thuộc loại liên kết ion.

1)
Số nguyên tử Al là 1,5.6.1023 = 9.1023 nguyên tử
Số phân tử H2 là 0,5.6.1023 = 3.1023 phân tử
Số phân tử NaCl là 0,25.6.1023 = 1,5.1023 phân tử
Số phân tử H2O là 0,05.6.1023 = 0,3.1023 phân tử
2)
$V_{CO_2} = 1.22,4 = 22,4(lít)$
$V_{H_2} = 2.22,4 = 44,8(lít)$
$V_{O_2} = 1,5.22,4 = 33,6(lít)$
$V_{hh} = (0,25 + 1,25).22,4 = 33,6(lít)$
1. Tính số nguyên tử hoặc phân tử trong mỗi lượng chất sau: 1,5 mol Al; 0,5 mol H2; 0,25 mol NaCl; 0,05 mol H2O.
1,5 mol Al có : \(1,5.6.10^{23}=9.10^{23}\) nguyên tử
0,5 mol H2 có : \(0,5.6.10^{23}=3.10^{23}\)phân tử
0,25 mol NaCl: \(0,25.6.10^{23}=1,5.10^{23}\) phân tử
0,05 mol H2O có : \(0,05.6.10^{23}=0,3.10^{23}\) phân tử

Câu 1:
* Hợp chất: \(H_2SO_4\), \(CO_2\), \(SO_3\), \(NaCl\), \(NO_2\), \(KMnO_4\)
* Đơn chất: \(S\), \(Cu\), \(N_2\), \(H_2\), \(Cl_2\), \(Fe\), \(O_3\)
Câu 2:
PTK:
- \(H_2SO_4:1.2+32.1+16.4=98\left(đvC\right)\)
- \(CO_2:12.1+16.2=44\left(đvC\right)\)
- \(SO_3:32.1+16.3=80\left(đvC\right)\)
- \(N_2:14.2=28\left(đvC\right)\)
- \(Na_2O:23.2+16.1=62\left(đvC\right)\)
- \(Cl_2:35,5.2=71\left(đvC\right)\)
Câu 3:
PTHH:
a) \(2SO_2+O_2\rightarrow2SO_3\)
b) \(4K+O_2\underrightarrow{t^o}2K_2O\)
c) \(8Al+3Fe_3O_4\underrightarrow{t^o}4Al_2O_3+9Fe\)
d) \(4P+5O_2\underrightarrow{t^o}2P_2O_5\)
câu 1;
hợp chất;h2so4, co2, so3, nacl, no2, kmn0
đơn chát còn lại

1)
| Đơn chất | S,Cu,N2,H2, Cl2, Fe, O3, O2 |
| Hợp chất | H2SO4; CO2; SO3; NaCl; NO2; KMnO4 |
2) PTKH2SO4 = 1.2 + 32.1 + 16.4 = 98 (đvC)
PTKCO2 = 12.1 + 16.2 = 44 (đvC)
PTKSO3 = 32.1 + 16.3 = 80 (đvC)
PTKN2 = 14.2 = 28(đvC)
PTKNa2O = 23.2 + 16.1 = 62(đvC)
PTKCl2 = 35,5.2 = 71 (đvC)
3)
a) \(2SO_2+O_2\xrightarrow[V_2O_5]{t^o}2SO_3\)
b) \(4K+O_2\underrightarrow{t^o}2K_2O\)
c) \(8Al+3Fe_3O_4\underrightarrow{t^o}4Al_2O_3+9Fe\)
d) \(4P+5O_2\underrightarrow{t^o}2P_2O_5\)

Số mol 3 chất trong 3,20 g hỗn hợp M: 
Số mol 3 chất trong 16 g M: 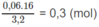
Khi đốt hỗn hợp M ta chỉ thu được C O 2 và H 2 O .
Vậy, các chất trong hỗn hợp đó chỉ có thể chứa C, H và O.
Đặt công thức chất X là C x H y O z thì chất Y là C x + 1 H y + 2 O z . Chất Z là đồng phân của Y nên công thức phân tử giống chất Y.
Giả sử trong 16 g hỗn hợp M có a mol chất X và b mol hai chất Y và Z :
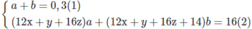
Khi đốt 16 g M thì tổng khối lượng C O 2 và H 2 O thu được bằng tổng khối lượng của M và O 2 và bằng :
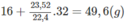
Mặt khác, số mol C O 2 = số mol H 2 O = n:
44n + 18n = 49,6 ⇒ n = 0,8
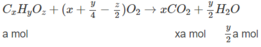
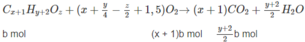
Số mol C O 2 là: xa + (x + 1)b = 0,8 (mol) (3)
Số mol
H
2
O
là: 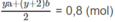
do đó: ya + (y + 2)b = 1,6 (4)
Giải hệ phương trình :
Biến đổi (3) ta có x(a + b) + b = 0,8
Vì a + b = 0,3 nên b = 0,8 - 0,3x
Vì 0 < b < 0,3 nên 0 < 0,8 - 0,3x < 0,3 ⇒ 1,66 < x < 2,66
x nguyên ⇒ x = 2 ⇒ b = 0,8 - 0,3.2 = 0,2
⇒ a = 0,3 - 0,2 = 0,1
Thay giá trị của a và b vào (4), tìm được y = 4.
Thay giá trị của a, b, x và y vào (2), tìm được z = 1.
Vậy chất X có CTPT là C 2 H 4 O , hai chất Y và z có cùng CTPT là C 3 H 6 O .
Chất X chỉ có thể có CTCT là 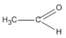 (etanal) vì chất
C
H
2
=
C
H
-
O
H
không bền và chuyển ngay thành etanal.
(etanal) vì chất
C
H
2
=
C
H
-
O
H
không bền và chuyển ngay thành etanal.
Chất Y là đồng đẳng của X nên
CTCT là 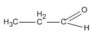 (propanal).
(propanal).
Hỗn hợp M có phản ứng với Na. Vậy, chất Z phải là ancol C H 2 = C H - C H 2 - O H (propenol):
2 C H 2 = C H - C H 2 - O H + 2Na → 2 C H 2 = C H - C H 2 - O N a + H 2 ↑
Số mol Z trong 48 g M là: 2. số mol H 2 = 0,15 (mol).
Số mol z trong 16 g M là: 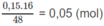
Số mol Y trong 16 g M là: 0,2 - 0,05 = 0,15 (mol).
Thành phần khối lượng của hỗn hợp M:
Chất X chiếm: 
Chất Y chiếm: 
Chất Z chiếm: 
khối lượng của CO2: C*1+O*2=12+32=44 (đvC)
khối lượng của H2O: H*2+O*1=2+16=18((đvC)
khối lượng của N2: N*2=14*2=28 (đvC)
khối lượng của O2: O*2=16*2=32(đvC)
khối lượng của H2: H*2=1*2=2 (đvC)
khối lượng của NaCL: Na*1 + Cl*1=23+35,5=58,5 (đvC)
Vì có cùng số phân tử ⇒ số mol cũng bằng nhau
\(\Rightarrow n_{CO_2}=n_{H_2O}=n_{O_2}=n_{N_2}=n_{H_2}=n_{NaCl}=\dfrac{0,6\times10^{23}}{6\times10^{23}}=0,1\left(mol\right)\)
\(\Rightarrow m_{CO_2}=0,1\times44=4,4\left(g\right)\)
\(m_{H_2O}=0,1\times18=1,8\left(g\right)\)
\(m_{O_2}=0,1\times32=3,2\left(g\right)\)
\(m_{N_2}=0,1\times28=2,8\left(g\right)\)
\(m_{H_2}=0,1\times2=0,2\left(g\right)\)
\(m_{NaCl}=0,1\times58,5=5,85\left(g\right)\)