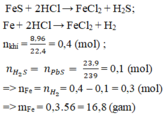Cho 11,36g hỗn hợp gồm Fe; FeO; Fe2O3; Fe3O4 phản ứng với HNO3 dư thu được 1,34l NO là sản phẩm duy nhất ở đktc và dung dịch X Cô cạn X thì thu được bao nhiêu gam muối khan
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.



Chọn D
Đáp án A sai, vì lượng Fe tạo thành nếu cho tiếp H 2 S O 4 dư vào thì Fe bị hòa tan hết.
Đáp án B sai, vì C u S O 4 sẽ phản ứng hết với Mg và Fe dẫn đến chỉ thu được kim loại Cu.
Đáp án c sai, vì A g N O 3 sẽ phản ứng hết với Mg và Fe dẫn đến chỉ thu được Ag và AgI.
Đáp án D đúng, vì khi Z n 2 + dư loại hết Mg ra thì Zn tiếp tục bị hòa tan bới NaOH thu được Fe

Gọi số mol Fe, S là a, b (mol)
=> 56a + 32b = 28,8 (1)
Do hỗn hợp Y chứa H2S, H2
=> Fe dư, S hết
PTHH: Fe + S --to--> FeS
b<---b------->b
Fe + 2HCl --> FeCl2 + H2
(a-b)------------------->(a-b)
FeS + 2HCl --> FeCl2 + H2S
b------------------------>b
=> \(\overline{M}_Y=\dfrac{2\left(a-b\right)+34b}{a-b+b}=9.2=18\left(g/mol\right)\)
=> a = 2b (2)
(1)(2) => a = 0,4 (mol); b = 0,2 (mol)
\(\%m_{Fe}=\dfrac{0,4.56}{28,8}.100\%=77,78\%\)

Gọi số mol H2, H2S là a, b (mol)
\(\left\{{}\begin{matrix}a+b=\dfrac{2,24}{22,4}=0,1\\M=\dfrac{2a+34b}{a+b}=9.2=18\left(g/mol\right)\end{matrix}\right.\)
=> a = 0,05 (mol); b = 0,05 (mol)
PTHH: Fe + 2HCl --> FeCl2 + H2
0,05<-------------------0,05
FeS + 2HCl --> FeCl2 + H2S
0,05<---------------------0,05
=> \(\%n_{Fe}=\%n_{FeS}=\dfrac{0,05}{0,05+0,05}.100\%=50\%\)
\(M_{hhkhí}=9.2=18\left(g\text{/}mol\right)\\ n_{hhkhí}=\dfrac{2,24}{22,4}=0,1\left(mol\right)\)
Áp dụng sơ đồ đường chéo, ta có:
\(\dfrac{n_{H_2S}}{n_{H_2}}=\dfrac{V_{H_2S}}{V_{H_2}}=\dfrac{34-18}{18-2}=\dfrac{1}{1}\)
\(\rightarrow n_{H_2S}=n_{H_2}=\dfrac{0,1}{2}=0,05\left(mol\right)\)
PTHH:
\(Fe+2HCl\rightarrow FeCl_2+H_2\uparrow\)
0,05<-----------------------0,05
\(FeS+2HCl\rightarrow FeCl_2+H_2S\uparrow\)
0,05<-------------------------0,05
\(\rightarrow\left\{{}\begin{matrix}\%n_{Fe}=\dfrac{0,05}{0,05+0,05}.100\%=50\%\\\%n_{FeS}=100\%-50\%=50\%\end{matrix}\right.\)

Số mol NaNO3 = 0,36 mol
số mol H2SO4 = 0,72 mol => số mol H+ = 1,44 mol
Ta có các bán phản ứng:
NO3- + 4H+ + 3e → NO + 2H2O (1)
mol 0,16 ← 4.0,16 0,16.3 ← 0,16
Số mol NO = 0,16 mol => H+ và NO3- dư, kim loại phản ứng hết.
Số mol NO3- phản ứng = 0,16 mol; số mol H+ phản ứng = 0,64 mol
Fe → Fe3+ + 3e(1)
Zn → Zn2+ + 2e(2)
Gọi số mol Fe là x mol, số mol Zn là y mol
Theo khối lượng hỗn hợp ban đầu ta có phương trình
56 x + 65 y = 10,62 (I)
Theo định luật bảo toàn electron ta có phương trình
3x + 2y = 0,16.3 (II)
Giải hệ phương trình (I), (II) ta có: x = 0,12 và y = 0,06 mol
mFe = 0,12.56 = 6,72 g => % mFe = 63,28%

Chọn đáp án A.
BTNT.N => nHNO3 = 0,4 × 3 + 5,6/22,4 = 1,45 mol.

\(n_{hhkhí\left(H_2,H_2S\right)}=\dfrac{2,24}{22,4}=0,1\left(mol\right)\)
Gọi \(\left\{{}\begin{matrix}n_{Fe}=a\left(mol\right)\\n_{FeS}=b\left(mol\right)\end{matrix}\right.\)
PTHH:
Fe + 2HCl ---> FeCl2 + H2
a a
FeS + 2HCl ---> FeCl2 + H2S
b b
Hệ pt \(\left\{{}\begin{matrix}56a+88b=7,2\\a+b=0,1\end{matrix}\right.\Leftrightarrow a=b=0,05\left(mol\right)\)