Bài 3. Hoà tan hết hỗn hợp X gồm Fe và Mg bằng một lượng vừa đủ dung dịch HCl 20%, thu được dung dịch
D. Nồng độ của FeCl2 trong dung dịch D là 15,757%.
a) Tính nồng độ phần trăm của MgCl2 trong dung dịch D.
b) Tính phần trăm khối lượng của Fe trong hỗn hợp X .
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Để đơn giản cho quá trình tính toán, ta sẽ chọn số mol Fe trong hỗn hợp ban đầu là 1 và đi tìm số mol của Mg tương ứng khi đó dựa vào các điều kiện giả thiết.
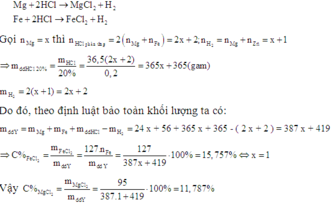
Đáp án A.

\(Fe\left(a\right)+2HCl\rightarrow FeCl_2\left(a\right)+H_2\)
\(Mg\left(1-a\right)+2HCl\rightarrow MgCl_2\left(1-a\right)+H_2\)
Đặt tổng số mol hỗn hợp là 1 mol.
Gọi a là số mol của Fe trong hỗn hợp trên (a < 1 )
=> \(n_{Mg}=\left(1-a\right)\left(mol\right)\)
\(\Rightarrow m_X=56a+\left(1-a\right)24=32a+24\left(g\right)\)
Theo PTHH \(n_{HCl}=2n_{hh}=2\left(mol\right)\)
\(\Rightarrow m_{HCl}=73\left(g\right)\)
\(\Rightarrow m_{ddHCl}=365\left(g\right)\)
Theo PTHH: \(n_{H_2}=n_{hh}=1\left(mol\right)\)
\(\Rightarrow m_{H_2}=2\left(g\right)\)
\(m dd sau = 32a+24+365-2=32a+387(g)\)
Theo đề, ta có: \(15,757=\dfrac{127a.100}{32a+387}\)
\(\Rightarrow a=0,5\)
Theo PTHH: \(n_{MgCl_2}=1-a\left(mol\right)\)
\(\Rightarrow C\%_{MgCl_2}=\dfrac{95\left(1-a\right).100}{32a+387}=\dfrac{95\left(1-0,5\right).100}{32.0,5+387}=11,7866\%\)

Đáp án B
Fe+2HCl → FeCl2 + H2
a 2a a a
Mg + 2HCl → MgCl2+H2
b 2b b b
mchất rắn X = 56a + 24b ; mddHCl = 36,5/20% .2.(a + b) = 365(a + b)
![]()
⇒ mddsau pư = 56a + 24b + 365(a + b) – 2(a + b) = 419a + 387b
![]() .100 = 15,76
.100 = 15,76
Giải PT ⇒ a = b ⇒ ![]() .100 = 11,79%
.100 = 11,79%

Chọn đáp án B
L ấ y 1 m o l F e : x m o l M g : x - 1 m o l
F e + 2 H C l → F e C l 2 + H 2 ↑ x 2 x x x
M g + 2 H C l → M g C l 2 + H 2 ↑ 1 - x 2 1 - x 1 - x 1 - x
n H 2 = 1 m o l , n H C l = 2 m o l ⇒ m d d H C l = 2 . 36 , 5 . 100 20 = 365 g m d d Y = 56 x + 24 1 - x + 365 - 1 . 2 = 387 + 32 x
C % F e C l 2 = 127 x 387 + 32 x . 100 % = 15 , 76 % ⇒ x = 0 , 5 m o l ⇒ C % M g C l 2 = 95 . 0 , 5 387 + 32 . 0 , 5 . 100 % = 11 , 79 %

Fe +2HCl --> FeCl2 +H2 (1)
Mg +2HCl --> MgCl2+H2(2)
giả sử có 1 mol hh
theo (1,2) : nHCl=2nhh=2(mol)
=>mddHCl=\(\dfrac{2.36,5.100}{20}=365\left(g\right)\)
nH2=nhh=1(mol)
=>mH2=2(g)
giả sử trong 1 mol hh có x mol Fe , y mol Mg
=> x+y=1(I)
mddsau pư=56x+24y+365-2=56x+24y+363(g)
=>\(\dfrac{127x}{56x+24y+363}.100=15,757\)(II)
từ (I) và (II) :
=>\(\left\{{}\begin{matrix}x=0,5\left(mol\right)\\y=0,5\left(mol\right)\end{matrix}\right.\)
theo (2) : nMgCl2=nMg=0,5(mol)
=> mMgCl2=47,5(g)
mdd sau pư=56.0,5+24.0,5+363=403(g)
=> C%ddMgCl2=\(\dfrac{47,5}{403}.100\approx11,79\left(\%\right)\)
b) %mFe=\(\dfrac{0,5.56}{0,5.\left(56+24\right)}.100=70\left(\%\right)\)

\(Fe+2HCl->FeCl_2=H_2\\ Mg+2HCl->MgCl_2+H_2\\ n_{Fe}=a;n_{Mg}=b\\ m_{ddHCl}=\dfrac{36,5.2\left(a+b\right)}{0,25}=292\left(a+b\right)\left(g\right)\\ m_{ddD}=292\left(a+b\right)+24a+56b-2\left(a+b\right)=314a+346b\left(g\right)\\ \%m_{FeCl_2}=\dfrac{127a}{314a+346b}=\dfrac{16,61}{100}\\ a=0,768b\\ \%m_{MgCl_2}=\dfrac{95b}{314a+346b}.100\%=\dfrac{95b}{314.0,768b+346b}.100\%=16,18\%\)

Giả sử có 365g dung dịch HCl
\(m_{HCl}=365.20\%=73\left(g\right)\)
\(n_{HCl}=\frac{73}{36,5}=2\)
Gọi công thức chung của kim loại là R
\(R+2HCl\rightarrow RCl_2+H_2\)
1____2______1___________
Gọi số mol: \(\left\{{}\begin{matrix}Fe:a\left(mol\right)\\Mg:b\left(mol\right)\end{matrix}\right.\)
\(a+b=1\left(1\right)\)
\(\frac{127a}{56a+24b+365-1.2}=15,76\%\)
\(\Leftrightarrow127a=8,8256+3,7825b+57,2088\)
\(\Rightarrow118,1744-3,7824b=57,2088\left(2\right)\)
\(\left(1\right)+\left(2\right)\Rightarrow\left\{{}\begin{matrix}a=0,5\\b=0,5\end{matrix}\right.\)
\(C\%_{MgCl2}=\frac{0,5.95}{365+56.0,5+24.0,5-1.2}.100\%=11,79\%\)

Fe+2HCl → FeCl2 + H2
a 2a a a
Mg + 2HCl → MgCl2+H2
b 2b b b
mchất rắn X = 56a + 24b ; mddHCl = 36,5/20% .2.(a + b) = 365(a + b)
⇒ mddsau pư = 56a + 24b + 365(a + b) – 2(a + b) = 419a + 387b
.100 = 15,76
Giải PT ⇒ a = b ⇒ .100 = 11,79%

a,Giả sử mddHCl = 36,5 (g) \(\Rightarrow n_{HCl}=\dfrac{36,5.0,2}{36,5}=0,2\left(mol\right)\)
PTHH: Fe + 2HCl → FeCl2 + H2
Mol: a 2a a a
PTHH: Mg + 2HCl → MgCl2 + H2
Mol: b 2b b b
Ta có: \(2a+2b=0,2\Leftrightarrow a+b=0,1\left(mol\right)\)
mdd D = 56a+24b+36,5-(a+b).2 = 56a+24b+36,3 (g)
\(C\%_{ddFeCl_2}=\dfrac{127a.100\%}{56a+24b+36,3}=15,757\%\)
\(\Leftrightarrow127a=8,82392a+3,78168b+5,719791\)
\(\Leftrightarrow118,17608a-3,78168b=5,719791\)
Ta có: \(\left\{{}\begin{matrix}a+b=0,1\\118,17608a-3,78168b=5,719791\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}a=0,05\\b=0,05\end{matrix}\right.\)
\(C\%_{ddMgCl_2}=\dfrac{95.0,05.100\%}{56.0,05+24.0,05+36,3}=11,79\%\)