Cần lấy bao nhiêu tấn quặng sắt chứ 95% Fe3O4 để sản xuất được 12,6 tấn sắt. Biết H% = 60 %
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Khối lượng Fe có trong gang là mFe = 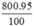 = 760 (tấn)
= 760 (tấn)
Khối lượng sắt thực tế cần để sản xuất gang (bị hao hụt 1%)
mFe = 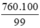 = 767,68 (tấn)
= 767,68 (tấn)
Fe3O4 + 4C → 4CO + 3Fe
232 3.56
x = ? 767,68 (tấn)
Khối lượng Fe3O4 là mFe3O4 = 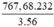 = 1060,13 (tấn)
= 1060,13 (tấn)
Khối lượng quặng manhetit là m = 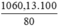 = 1325,163 (tấn)
= 1325,163 (tấn)

Khối lượng sắt có trong tấn gang chứa 95% sắt là : (tấn).
Khối lượng sắt thực tế cần phải có là : (tấn).
Fe3O4 -> 3Fe
232 tấn 3.56= 168 tấn
Muốn có 767,68 tấn sắt, cần : (tấn)Fe3O4
Khối lượng quặng manhetit cần dùng là : (tấn).

\(m_{FeS_2}=3.60\%=1,8\left(tấn\right)\)
Sơ đồ cả quá trình tạo H2SO4
FeS2 \(\rightarrow\) 2SO2 \(\rightarrow\) 2SO3 \(\rightarrow\) 2H2SO4
Giả sử: 120 tấn---------------------->196 tấn
1,8 tấn------------------------> x tấn
\(\Rightarrow m_{H_2SO_4\left(lt\right)}=x=\frac{1,8.196}{120}=2,94\left(tấn\right)\)
Vì H=95% => \(m_{H_2SO_4}=2,94.95\%=2,793\left(tấn\right)\)





