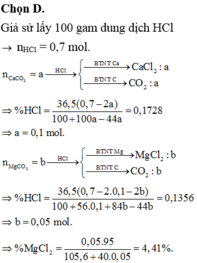cho một lượng bột CaCO3 tác dụng hoàn toàn với dung dịch HCl 32,85%. Sau khi phản ứng thu được dung dịch X trong đó nồng độ HCl còn lại là 24,20%.Thêm X một lượng bột MgCO3 khuấy đều cho phản ứng xảy ra hoàn toàn thu được dung dịch Y trong đó nồng độ HCl còn lại là 21,10%. Nồng độ phần trăm MgCl2 trong dung dịch Y là:
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án B
Chọn 1 mol HCl ban đầu. Gọi n C a C O 3 = x
Có phản ứng: C a C O 3 + 2 H C l → C a C l 2 + C O 2 + H 2 O (1)
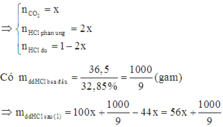
Do đó nồng độ phần trăm của HCl sau phản ứng (1) là:
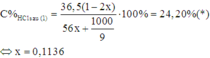
Do đó sau phản ứng (1) dung dịch X có mx = 117,47; nHCl dư = 0,7728
Gọi n M g C O 3 = y . Có phản ứng:
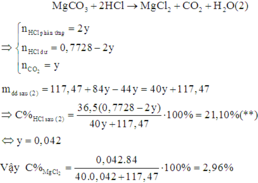
Do trong quá trình tính toán, ta có nhiều bước làm tròn nên dẫn đến sai số.
Khi đó ta sẽ chọn đáp án gần với kết quả tính được nhất.

Đáp án D
Giả sử có 100 gam dung dịch HCl 32,85% thì khối lượng HCl là 32,85 gam.
nHCl= 32 , 85 36 , 5 = 0,90 mol
- Gọi số mol của CaCO3 là x (mol). Phản ứng:
CaCO3 + 2HCl → CaCl2 + H2O + CO2 (1)
x 2x x x
Từ (1) và đề ra: nHCldư = (0,90 - 2x) mol
Khối lượng dung dịch X sau phản ứng (1): 100 + 100x – 44x = (100 + 56x) gam
Theo đề ra: C%HCl = ( 0 , 90 - 2 x ) . 36 , 5 100 + 56 x . 100 % = 24,195% => x = 0,1 mol
Vậy sau p/ư (1) nHCl còn lại = 0,7mol
- Cho MgCO3 vào dung dịch X, có p/ư:
MgCO3 + 2HCl → MgCl2 + H2O + CO2 (2)
y 2y y y
Sau p/ư (2) nHCl dư = 0,7-2y
Khối lượng dung dịch Y là: (105,6 + 84y - 44y) gam hay (105,6 + 40y) gam
Từ (2) và đề ra: C%HCl trong Y = ( 0 , 7 - 2 y ) . 36 , 5 105 , 6 + 40 y . 100% = 21,11% => y = 0,04 mol
Dung dịch Y chứa 2 muối CaCl2, MgCl2 và HCl dư:
C%(CaCl2) = 0 , 1 . 111 107 , 2 . 100 % = 10 , 35 %
C%(MgCl2) = 0 , 04 . 95 107 , 2 . 100 % = 3 , 54 %

Giả sử ban đầu có 100g dd HCl
\(\Rightarrow m_{HCl}=32,85\left(g\right)\)
\(\Rightarrow n_{HCl}=0,9\left(mol\right)\)
\(CaCO_3+2HCl\rightarrow CaCl_2+CO_2+H_2O\)
a___________2a_______a______a____________
\(m_{Dd_{Spu}}=100a+100-44a=56a+100\left(g\right)\)
\(n_{HCl_{Du}}=0,9-2a\left(mol\right)\)
\(m_{HCl_{du}}=32,85-73a\left(g\right)\)
\(\Rightarrow\frac{32,85-73a}{56a+100}=0,242\Leftrightarrow-73a+32,85=13,552a+24,2\)
\(\Rightarrow a=0,1\)
X có 0,1mol CaCl2 , 0,7mol HCl
\(MgCO_3+2HCl\rightarrow MgCl_2+CO_2+H_2O\)
b_________2b________b______b____________
\(m_{dd_{spu}}=84b+56.0,1+100-44b\)
\(=40b+105,6\left(g\right)\)
\(n_{HCl_{du}}=0,7-2b\left(mol\right)\)
\(\Rightarrow m_{HCl_{du}}=25,55-73b\)
\(\Rightarrow\frac{25,55-73b}{40b+105,6}=0,2111\)
\(\Leftrightarrow25,55b-73b=8,444b+22,29216\)
\(\Leftrightarrow b=0,04\)
\(\Rightarrow\) Y có 0,1mol CaCl2 , 0,04mol MgCl2 và HCl dư
\(\Rightarrow C\%_{CaCl2}=\frac{0,1.111.100}{40.0,04+105,6}=10,35\%\)
\(\Rightarrow C\%_{MgCl2}=\frac{0,04.95.100}{40.0,04+105,6}=3,54\%\)

Giả sử \(m_{dd_{HCl29,2\%}}=100\left(g\right)\)
\(\Rightarrow n_{HCl}=\frac{29,2}{36,5}=0,8\left(mol\right)\)
\(CaCO_3+2HCl\rightarrow CaCl_2+H_2O+CO_2\)
x_______2x__________x_____________x
\(m_{dd_{spu}}=100x+100-44x=56x+100\)
\(m_{HCl_{dư}}=36,5\left(0,8-2x\right)=29,2-73x\)
\(\Rightarrow\frac{29,2-73x}{56x+100}=0,2074\)
\(\Leftrightarrow29,2-73x=0,2074\left(56x+100\right)\)
\(\Leftrightarrow x=0,1\)
X có 0,6mol HCl ;0,1mol CaCl2
\(m_{ddX}=56.0,1+100=105,6\left(g\right)\)
\(BaCO_3+2HCl\rightarrow BaCl_2+CO_2+H_2O\)
y________2y______y_________y______________
\(m_{dd_{spu}}=197y+105,6+44y=153y+105,6\left(g\right)\)
\(\Rightarrow m_{HCL_{Dư}}=36,5.\left(0,06-2y\right)=21,9-73y\left(g\right)\)
\(\Rightarrow\frac{21,9-73y}{153y+105,6}=0,0852\)
\(\Leftrightarrow21,9-73y=0,0852.\left(153y+105,6\right)\)
\(\Leftrightarrow y=0,15\)
Y có 0,15mol BaCl2 ; 0,1mol CaCl2
\(m_{dd_Y}=153.0,15+105,6=128,55\left(g\right)\)
\(C\%_{CaCl2}=\frac{0,1.111.100}{128,55}=8,63\%\)
\(C\%_{BaCl2}=\frac{0,15.208.100}{128,55}=24,27\%\)

a, PT: \(Fe+S\underrightarrow{t^o}FeS\) (1)
\(FeS+2HCl\rightarrow FeCl_2+H_2S\)
\(Fe+2HCl\rightarrow FeCl_2+H_2\)
Gọi: \(\left\{{}\begin{matrix}n_{Fe}=x\left(mol\right)\\n_{FeS}=y\left(mol\right)\end{matrix}\right.\) ⇒ 56x + 88y = 12,24 - 1,28 (1)
Theo PT: \(n_{H_2S}+n_{H_2}=n_{FeS}+n_{Fe}=y+x=\dfrac{3,36}{22,4}=0,15\left(mol\right)\left(2\right)\)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}x=0,07\left(mol\right)\\y=0,08\left(mol\right)\end{matrix}\right.\)
Theo PT: \(n_{Fe\left(1\right)}=n_{S\left(1\right)}=n_{FeS}=0,08\left(mol\right)\)
⇒ nFe (ban đầu) = 0,08 + 0,07 = 0,15 (mol) ⇒ a = mFe = 0,15.56 = 8,4 (g)
mS = 0,08.32 + 1,28 = 3,84 (g)
b, nS = 3,84:32 = 0,12 (mol)
Xét tỉ lệ: \(\dfrac{0,15}{1}>\dfrac{0,12}{1}\), ta được Fe dư nếu pư hết.
Theo PT: \(n_{FeS\left(LT\right)}=n_S=0,12\left(mol\right)\)
\(\Rightarrow H=\dfrac{0,08}{0,12}.100\%\approx66,67\%\)

Đáp án : B
Xét P1 và P2 : khi số mol HCl tăng thì khối lượng rắn tăng => ở P1 HCl thiếu
=> mrắn – mP1 = mCl pứ => nCl pứ = 0,5 mol = nHCl = 0,5a
=> a = 1 M
Gọi số mol Zn , Mg , Fe trong mỗi phần lần lượt là x , y , z
+) P2 : mrắn – mP2 = mCl pứ => nCl pứ = 0,7 mol < nHCl => kim loại phản ứng hết
=> 2x + 2y + 2z = 0,7 mol
+) P3 : nAg = 2nZn + 2nMg + nFe => 2x + 2y + 3z = 0,8 mol
,mmỗi P = 65x + 24y + 56z = 15,7g
=> x = z = 0,1 ; y = 0,15 mol
=> %nMg = 42,86%