Hòa tan hết hỗn hợp gồm a mol Zn và b mol Fe bằng dung dịch HCl 20% vừa đủ thu được dung dịch Y, trong đó nồng độ của FeCl2 là 9,961%. Tính tỉ số a/b và nồng độ phần trăm của ZnCl2
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Chọn đáp án B
L ấ y 1 m o l F e : x m o l M g : x - 1 m o l
F e + 2 H C l → F e C l 2 + H 2 ↑ x 2 x x x
M g + 2 H C l → M g C l 2 + H 2 ↑ 1 - x 2 1 - x 1 - x 1 - x
n H 2 = 1 m o l , n H C l = 2 m o l ⇒ m d d H C l = 2 . 36 , 5 . 100 20 = 365 g m d d Y = 56 x + 24 1 - x + 365 - 1 . 2 = 387 + 32 x
C % F e C l 2 = 127 x 387 + 32 x . 100 % = 15 , 76 % ⇒ x = 0 , 5 m o l ⇒ C % M g C l 2 = 95 . 0 , 5 387 + 32 . 0 , 5 . 100 % = 11 , 79 %

a,Giả sử mddHCl = 36,5 (g) \(\Rightarrow n_{HCl}=\dfrac{36,5.0,2}{36,5}=0,2\left(mol\right)\)
PTHH: Fe + 2HCl → FeCl2 + H2
Mol: a 2a a a
PTHH: Mg + 2HCl → MgCl2 + H2
Mol: b 2b b b
Ta có: \(2a+2b=0,2\Leftrightarrow a+b=0,1\left(mol\right)\)
mdd D = 56a+24b+36,5-(a+b).2 = 56a+24b+36,3 (g)
\(C\%_{ddFeCl_2}=\dfrac{127a.100\%}{56a+24b+36,3}=15,757\%\)
\(\Leftrightarrow127a=8,82392a+3,78168b+5,719791\)
\(\Leftrightarrow118,17608a-3,78168b=5,719791\)
Ta có: \(\left\{{}\begin{matrix}a+b=0,1\\118,17608a-3,78168b=5,719791\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}a=0,05\\b=0,05\end{matrix}\right.\)
\(C\%_{ddMgCl_2}=\dfrac{95.0,05.100\%}{56.0,05+24.0,05+36,3}=11,79\%\)

Để đơn giản cho quá trình tính toán, ta sẽ chọn số mol Fe trong hỗn hợp ban đầu là 1 và đi tìm số mol của Mg tương ứng khi đó dựa vào các điều kiện giả thiết.
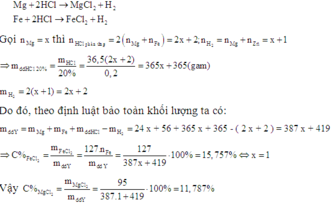
Đáp án A.

Đáp án B
Fe+2HCl → FeCl2 + H2
a 2a a a
Mg + 2HCl → MgCl2+H2
b 2b b b
mchất rắn X = 56a + 24b ; mddHCl = 36,5/20% .2.(a + b) = 365(a + b)
![]()
⇒ mddsau pư = 56a + 24b + 365(a + b) – 2(a + b) = 419a + 387b
![]() .100 = 15,76
.100 = 15,76
Giải PT ⇒ a = b ⇒ ![]() .100 = 11,79%
.100 = 11,79%

\(Fe+2HCl->FeCl_2=H_2\\ Mg+2HCl->MgCl_2+H_2\\ n_{Fe}=a;n_{Mg}=b\\ m_{ddHCl}=\dfrac{36,5.2\left(a+b\right)}{0,25}=292\left(a+b\right)\left(g\right)\\ m_{ddD}=292\left(a+b\right)+24a+56b-2\left(a+b\right)=314a+346b\left(g\right)\\ \%m_{FeCl_2}=\dfrac{127a}{314a+346b}=\dfrac{16,61}{100}\\ a=0,768b\\ \%m_{MgCl_2}=\dfrac{95b}{314a+346b}.100\%=\dfrac{95b}{314.0,768b+346b}.100\%=16,18\%\)

a) Gọi $n_{Al} =a (mol) ; n_{Fe} = b(mol) \Rightarrow 27a + 56b = 13(1)$
$2Al + 6HCl \to 2AlCl_3 + 3H_2$
$Fe + 2HCl \to FeCl_2 + H_2$
Theo PTHH : $n_{H_2} = 1,5a + b = \dfrac{6,72}{22,4} = 0,3(2)$
Từ (1)(2) suy ra : $a = \dfrac{1}{15} ; b = 0,2$
$\%m_{Al} = \dfrac{ \dfrac{1}{15}.27}{13}.100\% = 13,8\%$
$\%m_{Fe} = 100\% - 13,8\% = 86,2\%$
b) $n_{HCl} = 2n_{H_2} = 0,3.2 = 0,6(mol)$
$\Rightarrow C_{M_{HCl}} = \dfrac{0,6}{0,15} = 4M$
c) $n_{muối} = m_{kim\ loại} + m_{HCl} - m_{H_2} = 13 + 0,6.36,5 - 0,3.2 = 34,3(gam)$

\(Fe\left(a\right)+2HCl\rightarrow FeCl_2\left(a\right)+H_2\)
\(Mg\left(1-a\right)+2HCl\rightarrow MgCl_2\left(1-a\right)+H_2\)
Đặt tổng số mol hỗn hợp là 1 mol.
Gọi a là số mol của Fe trong hỗn hợp trên (a < 1 )
=> \(n_{Mg}=\left(1-a\right)\left(mol\right)\)
\(\Rightarrow m_X=56a+\left(1-a\right)24=32a+24\left(g\right)\)
Theo PTHH \(n_{HCl}=2n_{hh}=2\left(mol\right)\)
\(\Rightarrow m_{HCl}=73\left(g\right)\)
\(\Rightarrow m_{ddHCl}=365\left(g\right)\)
Theo PTHH: \(n_{H_2}=n_{hh}=1\left(mol\right)\)
\(\Rightarrow m_{H_2}=2\left(g\right)\)
\(m dd sau = 32a+24+365-2=32a+387(g)\)
Theo đề, ta có: \(15,757=\dfrac{127a.100}{32a+387}\)
\(\Rightarrow a=0,5\)
Theo PTHH: \(n_{MgCl_2}=1-a\left(mol\right)\)
\(\Rightarrow C\%_{MgCl_2}=\dfrac{95\left(1-a\right).100}{32a+387}=\dfrac{95\left(1-0,5\right).100}{32.0,5+387}=11,7866\%\)