Cho 80g bột đồng vào 200ml dung dịch AgNO3, sau 1 thời gian phản ứng đem lọc thu được dung dịch A và 95,2g chất rắn B. Cho tiếp 80g bột chì vào dung dịch A . Phản ứng xong thì tách được dung dịch D chỉ chứa một muối duy nhất và 67,05 g chất rắn E. Cho 40g kim loại R hóa trị 2 phản ứng với 1/10 dung dịch D . Sau phản ứng hoàn toàn đem lọc tách được 44,575 g chất rắn F.
A) Tính nồng độ mol dd AgNO3 ban đầu
B) Xác định tên kim loại R


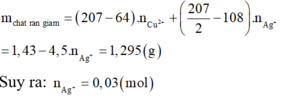

nAgNO3 pư Cu =\(\dfrac{2(95,2-80)}{108,2-64}\) = 0,2 mol
=> nAgNO3 dư = x - 0,2 mol
nCu(NO3)2 = 0,2/2 = 0,1 mol
Khi cho Pb vào A ta thu được 1 muối duy nhất nên đó phải là Pb(NO3)2 với số mol x/2 mol
=>mE = mPb dư + mCu + mAg
=(80 - 207x/2) + 0,1.64 + 108(x - 0,2) = 67,05
=> x = 0,5 mol
Nồng độ của AgNO3 là 0,5/0,2 = 2,5 M
Dung dịch D chứa 0,25 mol Pb(NO3)2
=> 1/10 D chứa 0,025 mol Pb(NO3)2, nếu lượng muối này pư hoàn toàn thì lượng chất rắn thu được tối thiểu là
mPb = 0,025.207 = 5,175 gam.
Vậy 44,575 gam phải có cả R dư
=> Pb(NO3)2 hết.
Cứ 1 mol Pb(NO3)2 pư thì khối lượng chất rắn tăng 207 - R (gam)
Mà 0,025 mol Pb(NO3)2 pư ......................... 44,575 - 40 = 4,575 gam
=> 0,025(207 - R) = 4,575
<=> R = 24
=> R là Magie( Mg)