Cho 40g hỗn hợp Al, Al2O3, MgO được hòa tan bằng dung dịch NaOH 2M thì thể tích NaOH vừa đủ phản ứng là 300ml đồng thời thoát ra 6,72 dm3 khí H2. Tìm % khối lượng của các chất ban đầu.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

\(n_{H2}=\dfrac{6,72}{22,4}=0,3\left(mol\right)\)
a) Pt : \(2Al+2NaOH+2H_2O\rightarrow2NaAlO_2+3H_2|\)
2 2 2 2 3
0,2 0,2 0,3
\(Al_2O_3+2NaOH\rightarrow2NaAlO_2+H_2O|\)
1 2 2 1
0,1 0,2
b) \(n_{Al}=\dfrac{0,3.2}{3}=0,2\left(mol\right)\)
\(m_{Al}=0,2.27=5,4\left(g\right)\)
\(m_{Al2O3}=15,6-5,4=10,2\left(g\right)\)
c) Có : \(m_{Al2O3}=10,2\left(g\right)\)
\(n_{Al2O3}=\dfrac{10,2}{102}=0,1\left(mol\right)\)
\(n_{NaOH\left(tổng\right)}=0,2+0,2=0,4\left(mol\right)\)
\(V_{ddNaOH}=\dfrac{0,4}{1}=0,4\left(l\right)=400\left(ml\right)\)
Chúc bạn học tốt

Lượng khí hidro thoát ra là 0,15 mol.
a) Al2O3 + 2NaOH \(\rightarrow\) 2NaAlO2 + H2O
2Al + 2NaOH + 2H2O \(\rightarrow\) 2NaAlO2 + 3H2.
b) Lượng Al phản ứng bằng 2/3 số mol khí hidro thoát ra và bằng 0,1 mol.
\(\Rightarrow\) %mnhôm=\(\dfrac{27.0,1}{12,9}\).100%\(\approx\)20,93%, %mnhôm oxit\(\approx\)100%-20,93%\(\approx\)79,07%.

Đáp án A
Cho phần 1 tác dụng với 0,4 mol NaOH thấy thoát ra 0,04 mol H2.
Do vậy Al dư 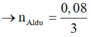
BTNT: ![]()
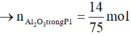
Ta có khối lượng mỗi phần là 39,44 gam.
![]()
Phần 2 tan trong HCl thu được dung dịch Z chứa 98,64 gam muối.
![]()
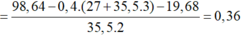
Giải được số mol Cr và Fe trong mỗi phần là 0,12 và 0,24 mol.
Bảo toàn O:
![]()
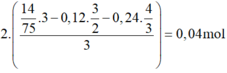

Đáp án A
Cho phần 1 tác dụng với 0,4 mol NaOH thấy thoát ra 0,04 mol H2.
Do vậy Al dư
→ n A l d ư = 0 , 08 3 B T N T : n A l ( P 1 ) = n N a O H = 0 , 4 → n A l 2 O 3 t r o n g P 1 = 14 75 m o l
Ta có khối lượng mỗi phần là 39,44 gam.
→ m C r + m F e = 19 , 68 g a m
Phần 2 tan trong HCl thu được dung dịch Z chứa 98,64 gam muối.
→ n C r + n F e = 98 , 64 - 0 , 4 ( 27 + 35 , 5 . 3 ) - 19 , 68 35 , 5 . 2 = 0 . 36
Giải được số mol Cr và Fe trong mỗi phần là 0,12 và 0,24 mol.
Bảo toàn O:
n A l 2 O 3 t r o n g X = 2 14 75 . 3 - 0 , 12 . 3 2 - 0 , 24 . 4 3 3 = 0 , 04 m o l → % A l 2 O 3 = 5 , 17 %
\(n_{NaOH}=0,3.2=0,6mol\)
\(n_{H_2}=\dfrac{6,72}{22,4}=0,3mol\)
- PTHH: 2Al+2NaOH+2H2O\(\rightarrow\)2NaAlO2+3H2
Al2O3+2NaOH\(\rightarrow\)2NaAlO2+H2O
\(n_{Al}=\dfrac{2}{3}n_{H_2}=\dfrac{2}{3}.0,3=0,2mol\)
\(m_{Al}=0,2.27=5,4g\)
\(n_{NaOH\left(2\right)}=0,6-n_{NaOH\left(1\right)}=0,6-0,2=0,4mol\)
\(n_{Al_2O_3}=\dfrac{1}{2}n_{NaOH\left(2\right)}=\dfrac{1}{2}.0,4=0,2mol\)
\(m_{Al_2O_3}=0,2.102=20,4g\)
\(m_{MgO}=40-5,4-20,4=14,2g\)
Từ đó: \(\%Al=\dfrac{5,4.100}{40}=13,5\%\)
\(\%Al_2O_3=\dfrac{20,4.100}{40}=51\%\)
%MgO=100%-13,5%-51%=35,5%
2Al + 2NaOH + 2H2O ----->2NaAlO2 + 3H2
Al2O3 + 2NaOH----->2NaAlO2 + H2O
nH2 = 0,3 mol
=> nAl = nNaOH = 0,3.2/3 = 0,2 mol
=> mAl = 0,2 . 27 = 5,4 => %Al = 13,5 %
theo đề bài nNaOH = 0,6 => n_NaOH còn lại = 0,6 - 0,2 = 0,4
=> nAl2O3 = 1/2nNaOH = 0,4/2 = 0,2
=> mAl2O3 = 0,2 . 102 = 20,4 => %Al2O3 = 51 %
=> %MgO = 100 - ( 13,5 + 51 ) = 35,5 %