Khi phân hủy bằng nhiệt 14,2g CaCO3 và MgCO3 ta thu được 3,36 lít CO2 ở đktc. Thành phần phần trăm về khối lượng các chất trong hỗn hợp đầu là:
A. 29,58% và 70,42%.
B. 70,42% và 29,58%.
C. 65% và 35%.
D. 35% và 65%
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Chọn B
![]()
Gọi số mol của CaC O 3 và MgC O 3 lần lượt là x và y mol

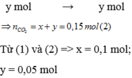
![]()
![]()

Gọi số mol MgCO3, CaCO3 là a, b (mol)
=> 84a + 100b = 1,84 (1)
PTHH: MgCO3 --to--> MgO + CO2
a-------------------->a
CaCO3 --to--> CaO + CO2
b-------------------->b
=> a + b = \(\dfrac{0,448}{22,4}=0,02\) (2)
(1)(2) => a = 0,01 (mol); b = 0,01 (mol)
=> \(\left\{{}\begin{matrix}\%m_{MgCO_3}=\dfrac{0,01.84}{1,84}.100\%=45,65\%\\\%m_{CaCO_3}=\dfrac{0,01.100}{1,84}.100\%=54,35\%\end{matrix}\right.\)

a, PT: \(CaCO_3+2HCl\rightarrow CaCl_2+CO_2+H_2O\)
\(MgCO_3+2HCl\rightarrow MgCl_2+CO_2+H_2O\)
Ta có: 100nCaCO3 + 84nMgCO3 = 14,2 (1)
Theo PT: \(n_{CO_2}=n_{CaCO_3}+n_{MgCO_3}=\dfrac{3,36}{22,4}=0,15\left(mol\right)\left(2\right)\)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}n_{CaCO_3}=0,1\left(mol\right)\\n_{MgCO_3}=0,05\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}\%m_{CaCO_3}=\dfrac{0,1.100}{14,2}.100\%\approx70,42\%\\\%m_{MgCO_3}\approx29,58\%\end{matrix}\right.\)
b, Theo PT: \(n_{HCl}=2n_{CO_2}=0,3\left(mol\right)\Rightarrow C_{M_{HCl}}=\dfrac{0,3}{0,6}=0,5\left(M\right)\)
PTHH :
\(CaCO_3+2HCl\rightarrow CaCl_2+H_2O+CO_2\)
x 2x x x x
\(MgCO_3+2HCl\rightarrow MgCl_2+H_2O+CO_2\uparrow\)
y 2y y y y
Có:
\(\left\{{}\begin{matrix}100x+84y=14,2\\x+y=\dfrac{3,36}{22,4}=0,15\end{matrix}\right.\)
\(\Rightarrow x=0,1;y=0,05\)
\(a,\%m_{CaCO_3}=0,1.100:14,2.100\%\approx72,423\%\)
\(\%m_{MgCO_3}=100\%-72,423\%\approx29,577\%\)
\(b,C_{M\left(HCl\right)}=\dfrac{0,2+0,1}{0,6}=0,5\left(M\right)\)

Gọi số mol CaCO3, MgCO3 là a, b (mol)
=> 100a + 84b = 14,2 (1)
\(n_{CO_2}=\dfrac{6,6}{44}=0,15\left(mol\right)\)
PTHH: CaCO3 --to--> CaO + CO2
a-------------------->a
MgCO3 --to--> MgO + CO2
b---------------------->b
=> a + b = 0,15
=> a = 0,1; b = 0,05
=> \(\left\{{}\begin{matrix}\%m_{CaCO_3}=\dfrac{100.0,1}{14,2}.100\%=70,42\%\\\%m_{MgCO_3}=\dfrac{0,05.84}{14,2}.100\%=29,58\%\end{matrix}\right.\)
\(n_{CO_2}=\dfrac{6,6}{44}=0,15mol\)
\(CaCO_3\underrightarrow{t^o}CO_2+CaO\)
\(x\) \(\rightarrow\) \(x\)
\(MgCO_3\underrightarrow{t^o}MgO+CO_2\)
\(y\) \(\rightarrow\) \(y\)
\(\Rightarrow\left\{{}\begin{matrix}100x+84y=14,2\\x+y=0,15\end{matrix}\right.\Rightarrow\left\{{}\begin{matrix}x=0,1\\y=0,05\end{matrix}\right.\)
\(\%m_{CaCO_3}=\dfrac{0,1\cdot100}{14,2}\cdot100\%=70,42\%\)
\(\%m_{MgCO_3}=100\%-70,42\%=29,57\%\)

Đáp án D
nCO2= nCaCO3 = 0,15 mol
ð mCaCO3 = 15 gam
mX= mrắn + mCO2
= 17,4+ 0,15.44=24 gam
%mCaCO3= (15:24).100%=62,5%

MgCO3 ----> MgO + CO2
CaCO3 -----> CaO + CO2
0,15 (mol) <------------ 0,15 (mol) (1) đây ý nói là tổng lượng mol CO2 = tổng lượng hỗn hợp muối
MgCO3 + HCl -------> MgCl2 + CO2 + H20
CaCO3 + HCl --------> CaCl2 + CO2 + H20
=> n(MgCO3,CaCO3) = n(MgCl2,CaCl2) = 0,15 (mol)
=> M(MgCl2,CaCl2) = 317/3
Sau đó, ta đặt: C (là phần trăm của CaCl2 trong hỗn hợp muối)
1-C (là phần trăm của MgCl2 trong hỗn hợp muối)
Với C là 100% trong hỗn hợp đó
=> 111C + 95x(1-C) = 317/3
Từ đó suy ra: C= 2/3
Vì lượng muối trong hỗn hợp tác dụng với HCl bằng lượng từng muối trong hỗn hợp ban đầu nên
%CaCO3 = 2/3x100% = 66,667%
%MgCO3 = 1/3x100% = 33,33%

Na2CO3 không bị nhiệt phân, nên 2,24 lít khí sinh ra chính là CO2 do CaCO3 bị nhiệt phân theo phản ứng
![]()
Cách 1:
![]()
Áp dụng định luật bảo toàn khối lượng ta có:
m X = m c h ấ t r ắ n + m C O 2 = 11,6 + 0,1.44 = 16 (gam)
Vậy phần trăm khối lượng của CaCO3 trong hỗn hợp X là:
![]()
Cách 2:
Ta có:
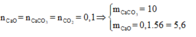
Hỗn hợp rắn thu được gồm CaO và Na2CO3
![]()
![]()
Đáp án D
\(n_{CaCO_3}=a\left(mol\right),n_{MgCO_3}=b\left(mol\right)\)
\(m=100a+84b=14.2\left(g\right)\left(1\right)\)
\(n_{CO_2}=\dfrac{3.36}{22.4}=0.15\left(mol\right)\)
\(CaCO_3\underrightarrow{^{^{t^0}}}CaO+CO_2\)
\(MgCO_3\underrightarrow{^{^{t^0}}}MgO+CO_2\)
\(\Rightarrow a+b=0.15\left(2\right)\)
\(\left(1\right),\left(2\right):a=0.1,b=0.05\)
\(\%CaCO_3=\dfrac{0.1\cdot100}{14.2}\cdot100\%=70.42\%\)
\(\%MgCO_3=29.58\%\)
Gọi số mol của \(CaCO_3\) và \(MgCO_3\) lần lượt là x và y => \(^m\)hỗn hợp = PT (1)
Phương trình hóa học:
\(CaCO_3\)→→ \(CaO+CO_2\)
x mol → x mol
\(MgCO_3\) →→ \(MgO+CO_2\)
y mol → y mol
=>\(n_{CO_2}\)=PT (2)
Đáp án là B