Nung hỗn hợp gồm 2.7 gam Al và 0.8 gam lưu huỳnh trong môi trường không có không khí. Sau phản ứng thu được hỗn hợp chất rắn A. Cho dung dịch HCl 7.3% phản ứng vừa đủ với A thu đuợc hỗn hợp khí B.
a)Tính C% dd muối sau phản ứng?
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

nFe = = 0,1 mol; ns =
= 0,05 mol.
a) Phương trình hoá học: Fe + S FeS.
Lúc ban đầu: 0,1 0,05 0 (mol)
Lúc phản ứng: 0,05 0,05 0,05
Sau phản ứng: 0,05 0 0,05
Chất rắn A gồm FeS và Fe dư + HCl?
FeS + 2HCl → FeCl2 + H2S
Phản ứng: 0,05 0,1 0,05 0,05 (mol)
Fe + 2HCl → FeCl2 + H2
Phản ứng: 0,05 0,1 0,05 0,05 (mol).
Số mol HCl tham giá phản ứng = 0,1 + 0,1 = 0,2 mol.
Thể tích dung dịch HCl 1M dùng là: Vdd = =
= 0,2 lít.

\(Fe+S-t^0->FeS\\ n_{Fe}:n_S=\dfrac{11,2}{56}:\dfrac{4,8}{32}=0,2:0,15\Rightarrow Fe:dư\left(0,05mol\right)\\ Fe+2HCl->FeCl_2+H_2\\ FeS+2HCl->FeCl_2+H_2S\\ d_{\dfrac{B}{kk}}=\dfrac{\dfrac{0,05.2+0,15.34}{0,2}}{29}=0,89655\)

Vì khi nung hỗn hợp trong môi trường không có không khí ( tức là cũng sẽ không có khí oxi ) và sẽ không xảy ra phản ứng
Sau phản ứng thu được chất rắn A là (Al) và S nhưng S không phản ứng với HCl nên chỉ có phản ứng giữa Al với HCl
a) Theo đề ta có :
\(nAl=\dfrac{2,7}{27}=0,1\left(mol\right)\)
PTHH :
2Al + 6HCl \(\rightarrow\) 2AlCl3 + 3H2\(\uparrow\)
0,1 mol...0,3mol...0,1mol...0,15mol
b) Khối lượng dung dịch HCl là :
mdd HCl = \(\dfrac{\left(0,3.36,5\right).100}{7,3}=150\left(g\right)\)
Tính C% của muối sau phản ứng :
Ta có :
mct = mAlCl3=\(0,1.133,5=13,35\left(g\right)\)
mddAlCl3 = 2,7 + 150 - (0,15.2) = 152,4 g
=> \(C\%_{AlCl3}=\dfrac{13,35}{152,4}.100\%\approx8,76\%\)
c) Ta có hỗn hợp khí B thu được là H2
Ta có :
\(VH2_{\left(\text{đ}ktc\right)}=0,15.22,4=3,36\left(l\right)\)
Vậy.........

Các PTHH:
Fe + S → FeS (1)
FeS + 2HCl → Fe Cl 2 + H 2 S (2)
Fe(dư) + 2HCl → Fe Cl 2 + H 2 (3)
HCl (dư) + NaOH → NaCl + H 2 O (4)
Thành phần của hỗn hợp khí A :
Theo (1) : 0,05 mol Fe tác dụng với 0,05 mol S, sinh ra 0,05 mol FeS.
Theo (2) : 0,05 mol FeS tác dụng với 0,10 mol HCl, sinh ra 0,05 mol H 2 S
Theo (3) : 0,05 moi Fe dư tác dụng với 0,10 mol HCl, sinh ra 0,05 mol HCl
Kết luận : Hỗn hợp khí A có thành phần phần trăm theo thể tích :
50% khí H 2 S và 50% khí H 2

Các PTHH:
Fe + S → FeS (1)
FeS + 2HCl → Fe Cl 2 + H 2 S (2)
Fe(dư) + 2HCl → Fe Cl 2 + H 2 (3)
HCl (dư) + NaOH → NaCl + H 2 O (4)
Nồng độ mol của dung dịch HCL :
Tổng số mol HCL tham gia các phản ứng (2), (3), (4) :
0,1 + 0,1 + 0,0125 = 0,2125 (mol)
Nồng độ mol của dung dịch HCl : 0,2125/0,5 = 0,425 (mol/l)

Chú ý: Cr không tan trong kiềm loãng.
Hướng dẫn giải:
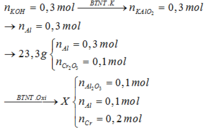
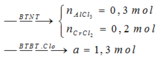
Đáp án A