Cho 300ml ddA chứa Ba(OH)2 0,2M và ddNaOH C1M vào lượng vừa đủ 400ml ddB chứa HCl 0,175M và H2SO4 C2M, sau khi phản ứng xảy ra hoàn toàn thu được 9,32 g kết tủa. Giá trị của C1 và C2 lần lượt là:
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


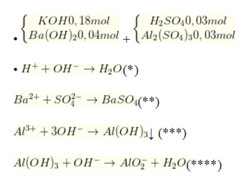
n O H - = n H + = 0 , 06 m o l T h e o ( * * ) n B a S O 4 = n B a 2 + = 0 , 04 m o l T h e o ( * * * ) n O H - = 3 x 0 , 03 x 2 = 0 , 18 m o l ; n A l ( O H ) 3 = 0 , 03 x 2 = 0 , 06 m o l T h e o ( * * * * ) n O H - = 0 , 18 + 0 , 04 x 2 - 0 , 06 - 0 , 18 = 0 , 02 m o l n A l ( O H ) 3 d ư = 0 , 06 - 0 , 02 = 0 , 04 m o l .
→ m↓ = mAl(OH)3 + mBaSO4 = 0,04 × 78 + 0,04 × 233 = 12,44 gam
→ Đáp án đúng là đáp án D

Đáp án : A
dd X : nH+ = 2nH2SO4 + nHCl = 0,02 mol
dd Y : nOH = nNaOH + 2nBa(OH)2 = 0,04 mol
=> Trong Y : nOH – nH+ = 0,02 mol = nOH- => COH = 0,1M => pH = 13

Số mol Fe và Cu lần lượt là 0,02 và 0,03 mol.
3Cu + 8H+ + 2NO3- ---> 3Cu2+ + 2NO + 4H2O
Fe + 4H+ + NO3- ---> Fe3+ + NO + 2H2O
Ta tính được số mol H+ dư là 0,24 mol
Số mol NO3- dư là 0,04 mol.
Vậy trong dung dịch X lúc này có
0,02 mol Fe3+
0,03 mol Cu2+
0,24 mol H+
Vậy lượng NaOH cần dùng là 0,02*3 + 0,03*2 + 0,24*1 = 0,36 mol
Vì không có nồng độ của dung dịch NaOH nên tiếp theo thì... chịu ^^

Ta có: nFe=0,02 mol; nCu= 0,03 mol, nH2SO4= 0,2 mol, nNaNO3= 0,08 mol
nH+= 2n H 2 S O 4 = 0,4 mol, n N O 3 -= 0,08 mol
3Cu + 8H+ + 2NO3-® 3Cu2+ + 2NO + 4H2O (1)
0,03 0,08 0,02 ® 0,03 mol
Fe + 4H+ + NO3- ® Fe3+ + NO + 2H2O (2)
0,02 0,08 0,02 ® 0,02 mol
Tổng số mol H+ tham gia phản ứng (1) và (2) là 0,08+ 0,08= 0,16 mol
→nH+ dư= 0,4-0,16= 0,24 mol
Dung dịch X có chứa Cu2+, Fe3+ và H+
H++ OH-→H2O (3)
Cu2++ 2OH- → Cu(OH)2 (4)
Fe3++ 3OH- → Fe(OH)3 (5)
Theo PT (3), (4), (5) ta có
nOH-= nH++ 2nCu2++ 3nFe3+= 0,24+ 2.0,03+ 3.0,02= 0,36 mol= nNaOH
→V= 0,36 lít= 360 ml
Đáp án A
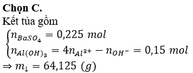
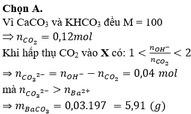


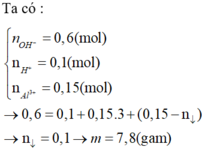
help