1, a) Cần lấy bao nhiêu gam dung dịch NaOH 20% trộn với 100g dung dịch NaOH 8% để thu được dung dịch mới có nồng độ 17,5%.
b) Hòa tan hoàn toàn 1 oxit kim loại M có hóa trị 2 bằng 1 lượng vừa đủ dung dịch H2SO4 20% ta được dung dịch A chứa MSO4 có nồng độ 22,64%. Xác định M.

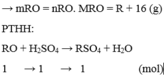
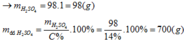
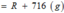
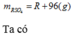

Đặt kim loại là \(M\), oxit là \(MO\).
Giả sử có \(1molMO\) phản ứng, \(1molH2SO4\) phản ứng:
\(MO+H2SO4\rightarrow MSO4+H_2O\)
\(C\%=\dfrac{mtc}{mdd}.100\%\)
\(10\%=\dfrac{1.90}{mdd}.100\%\)
\(\rightarrow mDd\) \(H2SO4=980g\)
Theo định luật bảo toàn khối lượng, ta có:
\(mdd=mMO+mddH2SO4=\left(M+16\right)+980=M+996\)
\(C\%\)muối \(=\dfrac{mctm}{mddm}.100\%\)
\(15.17\%=\dfrac{M+96}{M+996}.100\%\)
\(M=64,95g\)
\(MO+H_2SO_4--->MSO_4+H_2O\)
Gọi a là số mol của MO
\(=> mMO=(M+16)a \)\((g)\)
Theo PTHH \(nH_2SO_4=mMO=a(mol)\)
\(=>mH_2SO_4=98a(g)\)
\(=> mddH_2SO_4=\dfrac{98a.100}{20}=490a(g)\)
\(=> mdd sau =490a + (M+16)a\)
\(=(M+506).a\)\((g)\)
Theo PTHH \(nMSO_4=a(mol)\)
\(=> mMSO_4=(M+96).a\)\((g)\)
Theo đè, ta có: \(22,64=\dfrac{(M+96).a.100}{(M+506).a}\)
\(=>M=24\)
Kim loại M cần tìm là Mg