Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đặt kim loại M có hóa trị n khi phản ứng với 100g dung dịch HCl 20%
\(n_{HCl}=\dfrac{100.20\%}{36,5}=\dfrac{40}{73}\left(mol\right)\)
\(2M+2nHCl\rightarrow2MCl_n+nH_2\)
\(\dfrac{40}{73n}\)<----\(\dfrac{40}{73}\)-------> \(\dfrac{40}{73n}\)---> \(\dfrac{20}{73}\) (mol)
Theo ĐLBTKL :
=> \(m_{ddMCl_n}=\dfrac{40}{73n}.M+100-\dfrac{20}{73}.2=\dfrac{40.M}{73n}+\dfrac{7260}{73}\left(g\right)\)
\(C\%_{MCl_n}=\dfrac{\dfrac{40}{73n}.\left(M+35,5.n\right)}{\dfrac{40M}{73n}+\dfrac{7260}{73}}.100=23,36\)
Lập bảng :
| n | 1 | 2 | 3 |
| M | 9 | 18 | 27 |
| Kết luận | Loại | Loại | Chọn (Al) |
Vậy kim loại cần tìm là Nhôm (Al)

\(Đặt.oxit:A_2O_3\\ A_2O_3+3H_2SO_4\rightarrow A_2\left(SO_4\right)_3+3H_2O\\ n_{Al_2O_3}=\dfrac{34,2-10,2}{96.3-16.3}=0,1\left(mol\right)\\ M_{A_2O_3}=\dfrac{10,2}{0,1}=102\left(\dfrac{g}{mol}\right)=2M_A+48\\ \Rightarrow M_A=27\left(\dfrac{g}{mol}\right)\\ a,\Rightarrow A.là.nhôm\left(Al=27\right)\\ b,n_{H_2SO_4}=3.0,1=0,3\left(mol\right)\\ C\%_{ddH_2SO_4}=\dfrac{0,3.98}{100}.100=29,4\%\\ c,n_{Al_2\left(SO_4\right)_3}=n_{Al_2O_3}=0,1\left(mol\right)\\ Al_2\left(SO_4\right)_3+6NaOH\rightarrow2Al\left(OH\right)_3+3Na_2SO_4\\ n_{NaOH}=6.0,1=0,6\left(mol\right)\\ V_{ddNaOH}=\dfrac{0,6}{1,5}=0,4\left(l\right)\)

mNaOH=100.5%=5g
Gọi mddNaOH thêm =x(g)
=>mNaOH=0,2x
Tổng mNaOH=0,2x+5
Tổng mdd=x+100
=>0,2x+5=(x+100)0,1
=>0,1x=5=>x=50g

Giả sử có 1 mol M2On
PTHH: M2On + nH2SO4 --> M2(SO4)n + nH2O
1------->n------------>1
=> \(m_{H_2SO_4}=98n\left(g\right)\)
=> \(m_{dd.H_2SO_4}=\dfrac{98n.100}{19,6}=500n\left(g\right)\)
\(m_{dd.sau.pư}=500n+2.M_M+16n=2.M_M+516n\left(g\right)\)
\(m_{M_2\left(SO_4\right)_n}=2.M_M+96n\left(g\right)\)
\(C\%=\dfrac{2.M_M+96n}{2.M_M+516n}.100\%=24,096\%\)
=> MM = 18,665n (g/mol)
Chỉ có n = 3 thỏa mãn
=> MM = 56 (g/mol)
=> M là Fe
CTHH của oxit là Fe2O3

\(a,n_{H_2SO_4}=0,3.0,75+0,3.0,25=0,3\left(mol\right)\\ V_{ddH_2SO_4}=300+300=600\left(ml\right)=0,6\left(l\right)\\ \rightarrow C_{M\left(H_2SO_4\right)}=\dfrac{0,3}{0,6}=0,5M\\ m_{H_2SO_4}=0,3.98=29,4\left(g\right)\\ m_{ddH_2SO_4}=600.1,02=612\left(g\right)\\ \rightarrow C\%_{H_2SO_4}=\dfrac{29,4}{612}.100\%=4,8\%\)
\(b,\) Đặt kim loại M có hoá trị n (n ∈ N*)
PTHH: \(2M+nH_2SO_4\rightarrow M_2\left(SO_4\right)_n+nH_2\uparrow\)
\(\dfrac{0,6}{n}\)<---0,3--------------------------->0,3
\(\rightarrow M_M=\dfrac{5,4}{\dfrac{0,6}{n}}=9n\left(g\text{/}mol\right)\)
Vì n là hoá trị của M nên ta xét bảng
| \(n\) | \(1\) | \(2\) | \(3\) |
| \(M_M\) | \(9\) | \(18\) | \(27\) |
| \(Loại\) | \(Loại\) | \(Al\) |
Vậy M là Al
\(c,n_{KClO_3}=\dfrac{15,3125}{122,5}=0,125\left(mol\right)\)
PTHH:
\(2H_2+O_2\xrightarrow[]{t^o}2H_2O\)
0,3-->0,15
\(2KClO_3\xrightarrow[]{t^o}2KCl+3O_2\uparrow\)
0,1<---------------------0,15
\(\rightarrow H=\dfrac{0,1}{0,125}.100\%=80\%\)
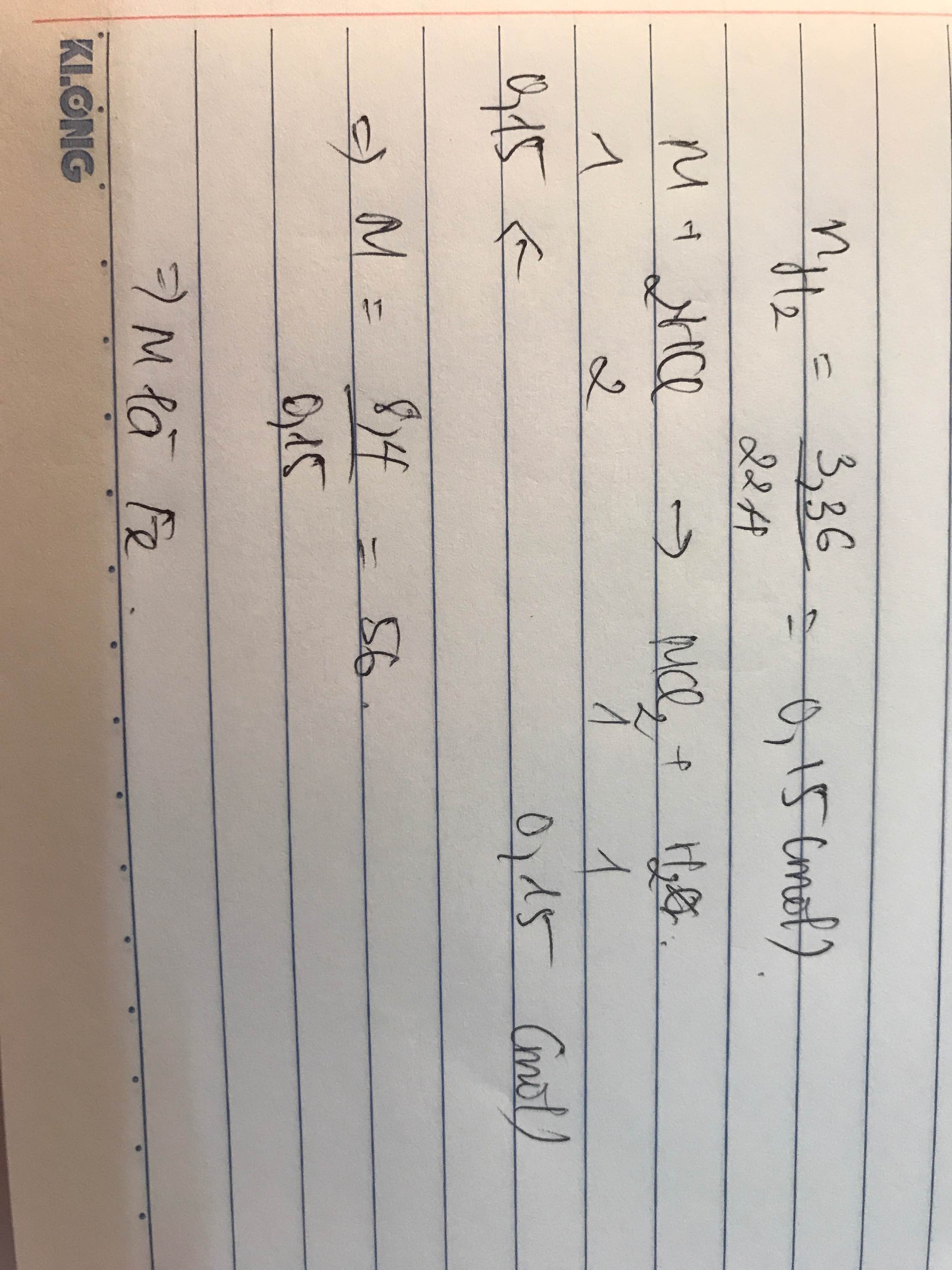
Đặt kim loại là \(M\), oxit là \(MO\).
Giả sử có \(1molMO\) phản ứng, \(1molH2SO4\) phản ứng:
\(MO+H2SO4\rightarrow MSO4+H_2O\)
\(C\%=\dfrac{mtc}{mdd}.100\%\)
\(10\%=\dfrac{1.90}{mdd}.100\%\)
\(\rightarrow mDd\) \(H2SO4=980g\)
Theo định luật bảo toàn khối lượng, ta có:
\(mdd=mMO+mddH2SO4=\left(M+16\right)+980=M+996\)
\(C\%\)muối \(=\dfrac{mctm}{mddm}.100\%\)
\(15.17\%=\dfrac{M+96}{M+996}.100\%\)
\(M=64,95g\)
\(MO+H_2SO_4--->MSO_4+H_2O\)
Gọi a là số mol của MO
\(=> mMO=(M+16)a \)\((g)\)
Theo PTHH \(nH_2SO_4=mMO=a(mol)\)
\(=>mH_2SO_4=98a(g)\)
\(=> mddH_2SO_4=\dfrac{98a.100}{20}=490a(g)\)
\(=> mdd sau =490a + (M+16)a\)
\(=(M+506).a\)\((g)\)
Theo PTHH \(nMSO_4=a(mol)\)
\(=> mMSO_4=(M+96).a\)\((g)\)
Theo đè, ta có: \(22,64=\dfrac{(M+96).a.100}{(M+506).a}\)
\(=>M=24\)
Kim loại M cần tìm là Mg