hòa tan 2,16 gam hỗn hợp Na,Al,Fe vào nước dư thu được 0,448 lít khí và 1 lượng chất rắn X. Cho X vào dung dịch CuSO4 dư , thu được 3,2 gam Cu. Tính khối lượng từng kim loại trong hỗn hợp ban đầu
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


a) \(n_{AlCl_3}=\dfrac{6,675}{133,5}=0,05\left(mol\right)\)
PTHH: 2Al + 6HCl --> 2AlCl3 + 3H2
0,05<-----------0,05---->0,075
=> \(\%Al=\dfrac{0,05.27}{14,15}.100\%=9,54\%\)
=> \(\%Cu=\dfrac{14,15-0,05.27}{14,15}.100\%=90,46\%\)
b) \(V_{H_2}=0,075.22,4=1,68\left(l\right)\)
c) \(n_{Cu}=\dfrac{14,15-0,05.27}{64}=0,2\left(mol\right)\)
PTHH: 4Al + 3O2 --to--> 2Al2O3
0,05->0,0375
2Cu + O2 --to--> 2CuO
0,2-->0,1
=> \(V_{O_2}=\left(0,1+0,0375\right).22,4=3,08\left(l\right)\)
\(2Al+6HCl\rightarrow2AlCl_3+3H_2\\ m_{AlCl_3}=6,675\left(mol\right)\\ n_{AlCl_3}=\dfrac{6,675}{133,5}=0,05\left(mol\right)\\ \Rightarrow n_{Al}=n_{AlCl_3}=0,05\left(mol\right)\\ \Rightarrow m_A=0,05.27=1,35\left(g\right);m_{Cu}=14,15-1,35=12,8\left(g\right)\\ \%m_{Cu}=\dfrac{12,8}{14,15}.100\approx90,459\%\\ \Rightarrow\%m_{Al}\approx9,541\%\\ b,n_{Cu}=\dfrac{12,8}{64}=0,2\left(mol\right)\\ n_{H_2}=\dfrac{3}{2}.n_{Al}=\dfrac{3}{2}.0,05=0,075\left(mol\right)\\ \Rightarrow V=V_{H_2\left(đktc\right)}=0,075.22,4=1,68\left(l\right)\\ 4Al+3O_2\rightarrow\left(t^o\right)2Al_2O_3\\ 2Cu+O_2\rightarrow\left(t^o\right)2CuO\\ n_{O_2}=\dfrac{3}{4}.n_{Al}+\dfrac{1}{2}.n_{Cu}=\dfrac{3}{4}.0,05+\dfrac{1}{2}.0,2=0,0875\left(mol\right)\)
\(\Rightarrow V_{O_2\left(đktc\right)}=0,0875.22,4=1,96\left(l\right)\)

Đáp án C
+ S ơ đ ồ p h ả n ứ n g : B a : x m o l A l F e : y m o l ⏟ m X = 9 , 61 g a m → H 2 ↑ : 0 , 12 m o l A l d ¨ o : y m o l F e : z m o l ⏟ h ỗ n h ợ p Y C u ↓ : 0 , 11 m o l B a ( A l O 2 ) 2 : x + B T E c h o ( 1 ) : 2 n B a ⏟ x + 3 n A l p ¨ o ⏟ 2 x = 2 n H 2 ⏟ 0 , 12 ⇒ x = 0 , 03 . + m Y = m X - m B a - m A l p ¨ o B T E c h o ( 2 ) : 3 n A l + 2 n F e = 2 n C u ⇒ 27 y + 56 z = 3 , 88 3 y + 2 z = 0 , 11 . 2 ⇒ x = 0 , 04 y = 0 , 05 ⇒ % m A l = 27 ( 0 , 06 + 0 , 04 ) 9 , 61 = 28 , 09 %

\(Fe+2HCl\rightarrow FeCl_2+H_2\)
Chất rắn không tan : Cu
\(m_{Cu}=3.2\left(g\right)\Rightarrow m_{Fe}=8-3.2=4.8\left(g\right)\)
\(\%Fe=\dfrac{4.8}{8}\cdot100\%=60\%\)
\(\%Cu=100\%-60\%=40\%\)

2Al + 2NaOH + 2H2O \(\rightarrow\) 2NaAlO2 + 3H2
CR X là Fe
Fe + 2HCl \(\rightarrow\) FeCl2 + H2
0,1 <----------------------- 0,1
%mFe = 50,91%
%mAl = 49,09%
cho mình bk lí do vì sao mà Al lại + với NaOH và H2O đc ko H2O ở đâu ra vậy bạn




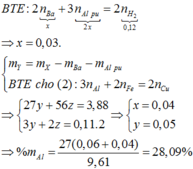
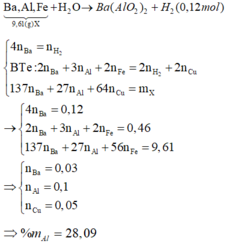
2Na + 2H2O → 2NaOH + H2
x............................x............0,5x
2Al + 2NaOH + 2H2O → 2NaAlO2 + 3H2
x........x.................................................1,5x
Đặt nNa = nAl phản ứng = x (mol)
Ta có : nH2 = 0,5x + 1,5x = 0,02
=> x = 0,01
Chất rắn không tan gồm Al dư (a_mol ) và Fe (b_mol)
mhh = 27a + 56b + 23x + 27x = 2,16
2Al + 3CuSO4 ---------> Al2(SO4)3 + 3Cu
a..........................................................1,5a
Fe + CuSO4 ---------> FeSO4 + Cu
b..................................................b
nCu = 1,5a + b = 0,05
=> a = b = 0,02
=> Y chứa Na (0,01), Al (0,03), Fe (0,02)
m Na= 0,01.23=0,23 (g)
m Al=0,03.27=0,81 (g)
m Fe= 0,02.56=1,12(g)