Cho 250 ml dung dịch FeCl2 0,2M tác dụng với 250 ml dung dịch NaOH 0,5M. Sau phản ứng, thu được dung dịch X và kết tủa Y. Lọc kết tủa, nung đến khối lượng không đổi, thu được m gam chất rắn. a) Viết phương trình hóa học của các phản ứng xảy ra và tính m. b) Tính CM của các chất trong dung dịch X (coi V không đổi).
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Bài 7 :
200ml = 0,2l
\(n_{CuCl2}=2.0,2=0,4\left(mol\right)\)
Pt : \(CuCl_2+2NaOH\rightarrow Cu\left(OH\right)_2+2NaCl|\)
1 2 1 2
0,4 0,8 0,4 0,8
\(Cu\left(OH\right)_2\underrightarrow{t^o}CuO+H_2O|\)
1 1 1
0,4 0,4
a) \(n_{CuO}=\dfrac{0,4.1}{1}=0,4\left(mol\right)\)
⇒ \(m_{CuO}=0,4.40=32\left(g\right)\)
b) \(n_{NaCl}=\dfrac{0,4.2}{1}=0,8\left(mol\right)\)
⇒ \(m_{NaCl}=0,8.58,5=46,8\left(g\right)\)
\(m_{ddCuCl2}=1,35.200=270\left(g\right)\)
\(m_{ddspu}=270+100=370\left(g\right)\)
\(C_{NaCl}=\dfrac{46,8.100}{370}=12,65\)0/0
Chúc bạn học tốt

Đáp án A
• 0,2a mol NaOH + 0,1 mol AlCl3 → ↓ Al(OH)3
Nung ↓ → 0,01 mol Al2O3
→ nAl(OH)3 = 0,02 mol.
• a lớn nhất khi NaOH dư
3NaOH + AlCl3 → Al(OH)3↓ + 3NaCl (*)
NaOH + Al(OH)3 → NaAlO2 + 2H2O (**)
Theo (*) nNaOH = 0,1 × 3 = 0,3 mol; nAl(OH)3 = 0,1 mol.
Theo (**) nAl(OH)3 phản ứng = 0,1 - 0,02 = 0,08 mol
→ nNaOH = 0,08 mol.
→ ∑nNaOH = 0,3 + 0,08 = 0,38 mol
→ CMNaOH = 0,38 : 0,2 = 1,9 M


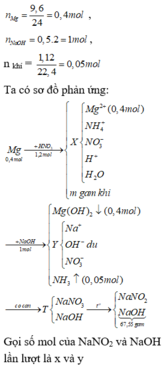






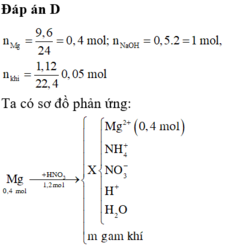
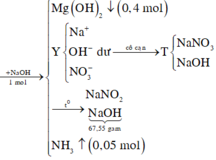


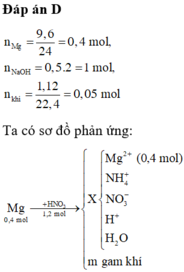



a,\(n_{FeCl_2}=0,25.0,2=0,05\left(mol\right);n_{NaOH}=0,25.0,5=0,125\left(mol\right)\)
PTHH: FeCl2 + 2NaOH → Fe(OH)2 + 2NaCl
Mol: 0,05 0,05 0,1
Tỉ lệ:\(\dfrac{0,05}{1}< \dfrac{0.125}{2}\) ⇒ FeCl2 pứ hết;NaOH dư
PTHH: \(Fe\left(OH\right)_2\underrightarrow{t^o}FeO+H_2O\)
Mol: 0,1 0,1
⇒ m=mFeO = 0,1.72 = 7,2 (g)
b,\(C_{MNaOHdư}=\dfrac{0,125-0,1}{0,5}=0,05M\)
\(C_{MNaCl}=\dfrac{0,1}{0,5}=0,2M\)