Cho 6,72 lít khí H2 ở đktc tác dụng với 40 gam sắt(III) oxit nung nóng. Biết chỉ xảy ra phản ứng khử sắt(III) oxit thành kim loại sắt. Thành phần phần trăm khối lượng của Fe có trong hỗn hợp sau phản ứng là ?
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Đáp án A
Ta có sơ đồ phản ứng:
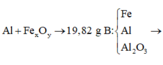
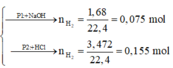
Phần 1:
2Al + 2NaOH + 2H2O → 2NaAlO2 + 3H2↑
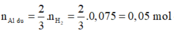
![]()
Phần 2:
2Al + 6HCl → 2AlCl3 + 3H2↑ (1)
0,05 → 0,075
Fe + 2HCl → FeCl2 + H2↑ (2)
![]()
![]()
![]()
![]()
Ta có phương trình phản ứng:
![]()
Khối lượng các chất trong 1 phần hỗn hợp B là 19,82/2 = 9,91 g
![]()
![]()
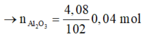
Ta có:
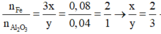
=> Oxit sắt cần tìm là Fe2O3



Qui đổi ½ hh B gồm Al (x mol), Fe (y mol), O (z mol)

=> mB = 2 (mAl + mFe + mO) = 102,78g
Gọi công thức của oxit sắt là FeaOb

=> Fe2O3

1)Khí sau phản ứng gồm :
CO : a(mol)
CO2:b(mol)
Bảo toàn nguyên tố với C: a + b = \(\dfrac{6,72}{22,4} = 0,3(mol)\)(1)
\(M_{khí} = 20.2 = 40(đvC)\)
Ta có : 28a + 44b = (a + b).40(2)
Từ (1)(2) suy ra : a = 0,075; b = 0,225
\(CO + O_{oxit} \to CO_2\\ n_{O(oxit)} = n_{CO_2} = 0,225(mol)\\ m_{Fe} + m_O = m_{oxit}\\ \Rightarrow n_{Fe} = \dfrac{13,05-0,225.16}{56}=0,16875(mol)\)
Ta thấy : \(\dfrac{n_{Fe}}{n_O} = \dfrac{0,16875}{0,225} = \dfrac{3}{4}\)
Vậy oxit cần tìm : Fe3O4
2) \(\%V_{CO_2} = \dfrac{0,225}{0,225+0,075}.100\% = 75\%\)

Ta co pthh
Fe2O3 + 3H2 \(\rightarrow\) 2Fe + 3H2O
Theo de bai ta co
nH2=\(\dfrac{6,72}{22,4}=0,3mol\)
nFe2O3=\(\dfrac{40}{160}=0,25mol\)
Theo pthh
nFe2O3=\(\dfrac{0,25}{1}mol>nH2=\dfrac{0,3}{3}mol\)
\(\Rightarrow\) Fe2O3 du sau phan ung
Theo pthh
nFe2O3=\(\dfrac{1}{3}nH2=\dfrac{1}{3}.0,3=0,1mol\)
\(\Rightarrow\) So gam Fe2O3 du sau phan ung la
mFe2O3=(0,25-0,1).160=24 g
Vay sau phan ung khoi luong Fe2O3 du la 24 g
ta có: nFe2O3=40:160=0,25(mol)
nH2=6,72:22,4=0,3(mol)
PTHH: Fe2O3(0,25) + 3H2(0,75) -> 2Fe + 3H2O
Vì theo pt thì số mol lớn hơn số mol theo đầu bài nên Fe2O3 dư
Vì Fe2O3 dư nên tính theo số mol của H2
PTHH: Fe2O3(0,1) + 3H2(0,3) -> 2Fe + 3H2O
Số mol Fe2O3 dư là: 0,25-0,1=0,15(mol)
-> mFe2O3dư=0,15.160=24(g)

\(n_{Cu}=\dfrac{19,2}{64}=0,3mol\)
\(Fe_2O_3+3H_2\rightarrow\left(t^o\right)2Fe+3H_2O\)
\(CuO+H_2\rightarrow\left(t^o\right)Cu+H_2O\)
0,3 0,3 ( mol )
\(m_{CuO}=0,3.80=24g\)
\(\Rightarrow m_{Fe_2O_3}=40-24=16g\)
\(\%m_{CuO}=\dfrac{24}{40}.100=60\%\)
\(\%m_{Fe_2O_3}=100\%-60\%=40\%\)
\(n_{Cu}=\dfrac{19,2}{64}=0,3mol\)
\(CuO+H_2\rightarrow Cu+H_2O\)
0,3 0,3
\(\Rightarrow n_{CuO}=0,3\Rightarrow m_{CuO}=24g\)
\(\Rightarrow m_{Fe_2O_3}=40-24=16g\Rightarrow n_{Fe_2O_3}=0,1mol\)
\(Fe_2O_3+3H_2\rightarrow2Fe+3H_2O\)
\(\%m_{CuO}=\dfrac{24}{40}\cdot100\%=60\%\)
\(\%m_{Fe_2O_3}=100\%-60\%=40\%\)

Đáp án B
Đặt công thức oxit sắt là FexOy có số mol là a mol
Ta có: nCO= 0,2 mol
FexOy+ yCO → t 0 xFe + yCO2
a ay ax ay mol
Sau phản ứng thu được ay mol CO2, (0,2-ay) mol CO dư
M ¯ = m h h n h h = 44 . a y + 28 . ( 0 , 2 - a y ) a y + 0 , 2 - a y = 40 → a y = 0 , 15 m o l T a c ó : m F e x O y = a ( 56 x + 16 y ) = 56 a x + 16 a y = 8 g a m → a x = 0 , 1 m o l → x y = a x a y = 0 , 1 0 , 15 = 2 3 → C ô n g t h ứ c o x i t l à F e 2 O 3
Sau phản ứng thu được 0,15 mol C O 2 và 0,05 mol CO dư
→ % V C O 2 = 0 , 15 0 , 2 . 100 % = 75 %

Đáp án A
· Có n Al ( B ) = 2 3 . n H 2 = 2 3 . 0 , 672 22 , 4 = 0 , 02 mol
· Chất rắn thu được sau khi nung là Al2O3:
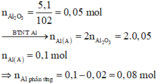
· Quy đổi A tương đương với hỗn hợp gồm 0,1 mol Al, a mol Fe, b mol O
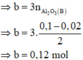
· Phần không tan D gồm Fe và oxit sắt + H2SO4 ® Dung dịch E + 0,12 mol SO2
Dung dịch E chứa một muối sắt duy nhất và không hòa tan được bột Cu
Þ Muối sắt là FeSO4.
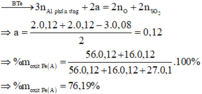


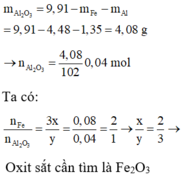
$n_{H_2} = \dfrac{6,72}{22,4} = 0,3(mol)$
$n_{Fe_2O_3} = \dfrac{40}{160} = 0,25(mol)$
$Fe_2O_3 + 3H_2 \xrightarrow{t^o} 2Fe + 3H_2O$
$n_{Fe_2O_3} : 1 = 0,25 > n_{H_2} : 3 = 0,1$ nên $Fe_2O_3$ dư
$n_{Fe} = \dfrac{2}{3}n_{H_2} = 0,2(mol)$
$n_{Fe_2O_3\ pư} = \dfrac{1}{3}n_{H_2} = 0,1(mol)$
$n_{Fe_2O_3\ dư} = 0,25 - 0,1 = 0,15(mol)$
Suy ra :
$\%m_{Fe} = \dfrac{0,1.56}{0,1.56 + 0,15.160}.100\% = 18,92\%$