Có thể điều chế được bao nhiêu kg sắt từ 1 tấn quặng có chứa 90% sắt từ oxit FeO4.
Biết lượng sắt bị hao hụt là 4%
Cho Fe=56 /O=16
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Khối lượng sắt có trong tấn gang chứa 95% sắt là : (tấn).
Khối lượng sắt thực tế cần phải có là : (tấn).
Fe3O4 -> 3Fe
232 tấn 3.56= 168 tấn
Muốn có 767,68 tấn sắt, cần : (tấn)Fe3O4
Khối lượng quặng manhetit cần dùng là : (tấn).

Khối lượng Fe có trong gang là mFe = 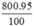 = 760 (tấn)
= 760 (tấn)
Khối lượng sắt thực tế cần để sản xuất gang (bị hao hụt 1%)
mFe = 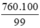 = 767,68 (tấn)
= 767,68 (tấn)
Fe3O4 + 4C → 4CO + 3Fe
232 3.56
x = ? 767,68 (tấn)
Khối lượng Fe3O4 là mFe3O4 = 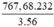 = 1060,13 (tấn)
= 1060,13 (tấn)
Khối lượng quặng manhetit là m = 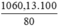 = 1325,163 (tấn)
= 1325,163 (tấn)

1 tấn=100000kg
\(m_{Fe_3O_4}=1000000.90\%=900000\left(g\right)\)
\(\rightarrow n_{Fe_3O_4}=\dfrac{900000}{232}=\dfrac{112500}{29}\left(mol\right)\)
\(4CO+Fe_3O_4\rightarrow3Fe+4CO_2\)
\(\dfrac{112500}{29}\) \(\dfrac{337500}{87}\) (mol)
\(\rightarrow m_{Fe}=\dfrac{337500}{87}.56\approx217241,38\left(g\right)\approx217,24\left(kg\right)\)
b.
\(n_{Fe}=\dfrac{1000000}{56}=\dfrac{125000}{7}\left(mol\right)\)
\(4CO+Fe_3O_4\rightarrow3Fe+4CO_2\)
\(\dfrac{375000}{7}\) \(\dfrac{125000}{7}\) (mol)
\(\rightarrow m_q=\dfrac{375000}{7}.232.100:90=13809523\left(g\right)=13809,5\left(kg\right)\)
\(4CO+Fe_3O_4\rightarrow3Fe+4CO_2\)
\(4CO+Fe_3O_4\rightarrow3Fe+4CO_2\)
\(4CO+Fe_3O_4\rightarrow3Fe+4CO_2\)

a) PTHH:
Fe3O4 + 4CO =(nhiệt)=> 3Fe + 4CO2
1 (mol)------------------------3 (mol)
232(kg)----------------------168(kg)
900 (kg)----------------------x (kg)
Ta có: Khối lượng Fe3O4 có trong 1 tân quặng là: mFe3O4 = 1 x 90% = 0.9 (tấn ) = 900 (kg)
Lập các tỉ lệ số mol và khối lượng theo phương trình ( x là khối lượng kim loại sắt thu được )
=> x = \(\frac{900\times168}{232}\approx651,72\left(kg\right)\)
b)PTHH:
Fe3O4 + 4CO =(nhiệt)=> 3Fe + 4CO2
1 (mol)----------------------3(mol)
232 (tấn)---------------------168 (tấn)
y (tấn)--------------------------1 (tấn)
Lập các số mol và khối lượng trên phương trình ( y là khối lượng Fe3O4 cần dùng )
=> y = \(\frac{1\times232}{168}=1,4\left(t\text{ấn}\right)\)
=> Khối lượng quặng cần dùng: mquặng = \(1,4\div\frac{90}{100}=1,556\left(t\text{ấn}\right)\)

Đáp án D
m C r = 216 . 0 , 65 = 140 , 4 k g ⇒ n C r = 2 , 7 k m o l ⇒ n F e ( C r O 2 ) 2 = 2 , 7 2 . 0 , 9 = 1 , 5 k m o l ⇒ m F e ( C r O 2 ) 2 = 336 k g % k h ố i l ư ợ n g h ợ p c h ấ t 1 - 336 1000 = 0 , 664 = 66 , 4 %