A) hãy xác định thể tích õi được sinh ra nhiều hơn khi lấy cùng một khối lượng kaliclorat; kalipenmanganat
B)để điều chế 8,96 lít oxi (đktc) thì chọn chất nào trong hai chất trên để có khối lượng nhỏ hơn
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Chọn phương án B.
Theo giả thuyết, thể tích của chiếc cột sắt là: V = 0,9m3 = 900dm3.
Vì 1dm3 sắt nguyên chất có khối lượng 7,8kg nên 900dm3 có khối lượng là:
m = 900.7,8 = 7020 kg = 7,02 tấn.
Vậy khối lượng của chiếc cột sắt là 7,02 tấn.

nC=\(\frac{3}{12}\)=0.4
C+02 -->CO2
0.4-->0.4----->0.4 mol
\(n_{oxidư}\)=\(\frac{16.8}{22.4}\)-0.4=0.35
\(n_p=\)\(\frac{16.8}{31}\)=0.54
4P+502 -->2 P2O5
0.28<--0.35 mol
\(n_{pdư}=\)0.54-0.28=0.26
\(m_{pdu}\)=0.26*31=8.06
Hình như đề bài sai bạn ơi
đốt cháy hết cacbon dư oxi
đốt cháy dư photpho thì pu hết oxi
sao mà dư được chất răn x và khí y được

Phương trình hóa học của phản ứng:
M + n/2HCl → M Cl n
M + mHCl → M Cl m + m/2 H 2
Theo đề bài, ta có:
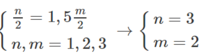
và M + 106,5 = 1,2886 (M+71)
Giải ra, ta có M = 52 (Cr)

a./ Khối lượng AgNO3 trong dd ban đầu: m(AgNO3) = 250.6% = 15g
Khối lượng AgNO3 pư: m(AgNO3 pư) = 17%.15 = 2,55g
→ n(AgNO3) = 2,55/170 = 0,015mol
2AgNO3 + Cu → 2Ag + Cu(NO3)2
0,015___0,0075_0,015__0,0075
Khối lượng của vật lấy ra sau pư:
m = 50 + m(Ag) - m(Cu pư) = 50 + 0,015.108 - 0,0075.64 = 51,14g
b./ Khối lượng các chất có trong dd sau pư:
m[Cu(NO3)2] = 0,0075.188 = 1,41g
m(AgNo3 dư) = m(AgNO3) - m(AgNO3 pư) = 15 - 2,55 = 12,45g
Khối lượng dd thu được:
m(dd) = m(dd AgNO3) + m(Cu pư) - m(Ag) = 250 + 0,0075.64 - 0,015.108 = 248,86g
Thành phần % các chất có trong dung dịch
%AgNO3 dư = 12,45/248,86 .100% = 5%
%Cu(NO3)2 = 1,41/248,86 .100% = 0,57%

Đáp án C.
Khi hệ cân bằng:
sin α = 0 , 5 r ℓ → α = 30 0 tan α = F m g = k q 2 m g r 2 ⇒ q = m g r 2 tan α k
⇒ q = 0 , 2 . 10 . 0 , 05 2 tan 2 , 866 0 9 . 10 9 = 5 , 66 . 10 - 6 C
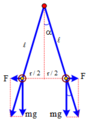

đáp án C
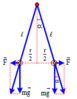
+ Khi hệ cân bằng
sin α = 0 , 5 r ℓ → α = 30 0 tan α = F m g = k q 2 m g r 2 ⇒ q = m g r 2 tan α k
A) kalipenmanganat
B)kaliclorat