Để hòa tan hoan toàn 64g oxit kim loại có hóa trị là: 3 cần vừa đủ 800ml dung dịch HNO3 3M
a, tìm công thức hóa học của oxit kim loại
b, tìm nồng độ mol dung dịc muối sau phản ứng biết thể tích dung dịch thay đổi không đáng kể
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Kim loại cần tìm đặt là A.
=> CTHH oxit: A2O3
\(A_2O_3+H_2SO_4\rightarrow A_2\left(SO_4\right)_3+3H_2O\\ m_{ddsau}=10,2+331,8=342\left(g\right)\\ m_{A_2\left(SO_4\right)_3}=\dfrac{342}{100}.10=34,2\left(g\right)\\ n_{oxit}=\dfrac{34,2-10,2}{96.3-16.3}=0,1\left(mol\right)\\ M_{A_2O_3}=\dfrac{10,2}{0,1}=102\left(\dfrac{g}{mol}\right)=2M_A+48\left(\dfrac{g}{mol}\right)\\ \Rightarrow M_A=\dfrac{102-48}{2}=27\left(\dfrac{g}{mol}\right)\\ \Rightarrow A:Nhôm\left(Al=27\right)\\ \Rightarrow CTHH.oxit:Al_2O_3\)

Gọi CT của oxit : RO
n RO = a ( mol )
PTHH:
RO + H2SO4 ====> RSO4 + H2O
a--------a------------------a
theo pthh:
n H2SO4 = n RSO4 = n RO = a ( mol )
Có: n H2SO4=a ( mol ) => m H2SO4 = 98a ( g )
=> m dd H2SO4 20% = 490a ( g )
BTKL: m dd sau phản ứng = a ( R + 16 ) + 490a = aR + 506a ( g )
Lại có :
n RSO4 = a ( mol ) => m RSO4 = aR + 96a
=> \(\dfrac{aR+96a}{aR+506a}=\dfrac{22,64}{100}\Rightarrow\dfrac{a\left(R+96\right)}{a\left(R+506\right)}=\dfrac{22,64}{100}\)
\(\Rightarrow R=24\left(Mg\right)\)
Vậy CT: MgO

CT oxit KL là \(R_2O_3\)
PTHH: \(R_2O_3+6HNO_3\rightarrow2R\left(NO_3\right)_3+3H_2O\)
\(n_{R_2O_3}=\dfrac{1}{6}n_{HNO_3}=\dfrac{1}{6}.\left(0,8.3\right)=0,4\left(mol\right)\)
\(M_{R_2O_3}=\dfrac{64}{0,4}=160\left(g/mol\right)\)
\(2R+3.16=160\\ R=56\)
Vậy R là Fe. CT của oxit là \(Fe_2O_3\)

a)Giả sử có 1 mol MO phản ứng
\(MO+2HCl\rightarrow MCl_2+H_2O\)
1----------->2----------->1----------->1
=> \(m_{ddHCl}=\dfrac{2.36,5}{10\%}=730\left(g\right)\)
\(m_{ddsaupu}=\left(M+16\right)+730=M+746\left(g\right)\)
=> \(C\%_{MCl_2}=\dfrac{M+71}{M+746}.100=12,34\)
=> M=24 (Mg)
b) Giả sử có 1 mol M2On phản ứng
\(M_2O_n+2nHCl\rightarrow2MCl_n+nH_2O\)
1---------------->2n-------------->2----------->n
=> \(m_{ddHCl}=\dfrac{2n.36,5}{10\%}=730n\left(g\right)\)
\(m_{ddsaupu}=\left(2M+16n\right)+730n=2M+746n\left(g\right)\)
=> \(C\%_{MCl_2}=\dfrac{2\left(M+35,5n\right)}{2M+746n}.100=12,34\)
Chạy nghiệm n=1,2,3
n=1 => M=12 (loại)
n=2 => M=24 (Mg)
n=3 => M=36 (loại)

Chọn C
Gọi công thức của oxit hóa trị II là RO
Đặt mol RO = 1 (mol)
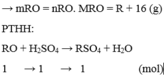
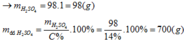
![]()
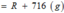
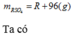

Vậy công thức của oxit kim loại là MgO

CTHH cần tìm : $R_2O_3$
Coi $n_{H_2SO_4} = 3(mol)$
R2O3 + 3H2SO4 → R2(SO4)3 + 3H2O
1..............3..................1..................................(mol)
Ta có :
$m_{dd\ H_2SO_4} = \dfrac{3.98}{10\%} = 2940(gam)$
$m_{dd\ sau\ pư} = 2R + 16.3 + 2940 = 2R + 2988(gam)$
Suy ra :
$C\% = \dfrac{2R + 96.3}{2R + 2988}.100\% = 12,9\%$
$\Rightarrow R = 56(Fe)$
Vậy oxit là $Fe_2O_3$
Gọi công thức tổng quát oxit đó là A2O3
A2O3+6HNO3->2A(NO3)3+3H2O
nHNO3=2.4(mol)
nA2O3=0.4(mol)
MA2O3=64:0.4=160(g/mol)
MA=(160-48):2=56(g/mol)
->Kim loại đó là Fe
CTHH của oxit đó là Fe2O3
nFe(NO3)3=0.8(mol)
CM=0.8:0.8=1(M)
cam on ban