Hòa tan hoàn toàn a (g) oxit của một Kim loại hóa trị II trong 48g dung dịch H2SO4 lít, nồng độ 6,125% thu được dung dịch chất tan trong đó H2SO4 có nồng độ 0,98%. Mặt khác dùng 2,8 lít CO để khử a (g) oxit trên thành kim loại thu được khí B duy nhất. Nếu lấy 0,896 lít khí B cho vào dung dịch Ca(OH)2 dư thu được 0,8 g kết tủa. tìm giá trị của a và xác định công thức của oxit kim loại đó . Biết các thể tích khí đó cùng đktc
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

gọi kim oxit kim loại đó là RO
n là số mol của oxit kim loại
M là nguyên tử khối của kim loại R
48 gam dd H2SO4 6,125% chứa 0,03 mol H2SO4
RO + H2SO4 ----> RSO4 + H2O
n -----> n mol
phản ứng kết thúc, H2SO4 vẫn còn dư => n < 0,03 mol
theo định luật bảo toàn khối lượng, khối lượng dung dịch sau phản ứng là:
m= n(M + 16) + 48
khối lượng H2SO4 còn lại là 98(0,03 - n)
dd T chứa H2SO4 0,98%
=> 98(0,03 - n) x 100 / [n(M + 16) + 48] = 0,98 (**)
tạm thời ta chưa biến đổi phương trình trên
dùng 2,8 lít CO để khử hoàn toàn oxit đó
RO + CO ---> R + CO2
Nhìn vào phản ứng trên ta thấy phản ứng thực chất là thay thế một phân tử CO bằng 1 phân tử CO2
=> số phân tử khí trong hỗn hợp vẫn không thay đổi
=> thể tích cũng như số mol của hỗn hợp khí sau phản ứng và trước phản ứng là giống nhau
=> sau phản ứng cũng thu được 2,8 lít hỗn hợp khí CO và CO2 (trước phản ứng chỉ có mỗi CO)
0,7 lít khí sục vào dd Ca(OH)2 dư => 0,625 gam kết tủa =>0,00625 mol CO2
0,7 lít hỗn hợp khí thì chứa 0,00625 mol CO2
=> 2,8 lít hỗn hợp khí chứa 0,025 mol CO2
theo phản ứng khử RO bằng CO thì số mol RO bằng số mol CO2
=> n = 0,025
thế n vào phương trình (**) rồi biến đổi ta tìm được M = 64
=> R là Cu
=> => a = 2 gam
sau phản ứng ta thu được 50 gam dd T gồm
0,025 mol CuSO4
0,005 mol H2SO4 còn dư
=> 20 gam dd T chứa :
0,01 mol CuSO4
0,002 mol H2SO4
phản ứng với xút (NaOH)
CuSO4 + 2NaOH ---> Cu(OH)2 + Na2SO4
0,01 --- ---> 0,02 ----- --> 0,01 ---- -->0,01 mol
H2SO4 + 2NaOH ---> Na2SO4 + H2O
0,002 -----> 0,004-----> 0,002

Chọn C
Gọi công thức của oxit hóa trị II là RO
Đặt mol RO = 1 (mol)
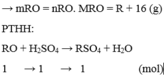
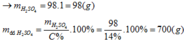
![]()
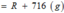
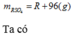

Vậy công thức của oxit kim loại là MgO

CT oxit : MO
Đặt số mol oxit phản ứng là 1 mol
\(MO+H_2SO_4\rightarrow MSO_4+H_2O\)
\(m_{ddH_2SO_4}=\dfrac{1.98}{15,8\%}=620,25\left(g\right)\)
\(m_{ddsaupu}=620,25+M+16=M+636,25\left(g\right)\)
Ta có : \(C\%_{MSO_4}=\dfrac{M+96}{M+636,25}.100=22,959\)
=> M=65 (Zn)
=> Oxit kim loại : ZnO (Kẽm oxit)

Phân tử khối của mỗi chất là: M = 1,875.32 = 60
Gọi CTPT là CxHyOz
+ z = 1: 12x + y = 44
Do 0 < H ≤ 2C + 2 => 0 < y ≤ 2x+2 => 0 < 44-12x ≤ 2x+2 => 3 ≤ x < 3,67 => x = 3
CTPT là C3H8O
+ z = 2: 12x + y = 28
Do 0 < H ≤ 2C + 2 => 0 < y ≤ 2x+2 => 0 < 28-12x ≤ 2x+2 => 1,857 ≤ x < 2,33 => x = 2
CTPT là C2H4O2
- Do X, Y, Z đều có khả năng phản ứng với Na nên có chứa nhóm –OH hoặc –COOH.
- Y tác dụng với dung dịch NaHCO3 nên Y là hợp chất axit. Công thức phân tử của Y là C2H4O2. Công thức cấu tạo của Y là CH3COOH.
- Khi oxi hóa X tạo X1 có khả năng tham gia phản ứng tráng gương nên X là ancol bậc 1. Công thức phân tử của X là C3H8O. Công thức cấu tạo của X là: CH3-CH2-CH2-OH.
- Chất Z có khả năng tham gia phản ứng tráng gương nên Z có chứa nhóm chức –CHO. Công thức phân tử của Z là C2H4O2. Công thức cấu tạo của Z là HO-CH2-CHO.
Chú ý:
+ Tác dụng với Na thì trong phân tử có nhóm – OH hoặc –COOH
+ Có phản ứng tráng bạc => trong phân tử có nhóm –CHO

Câu 3 :
\(n_{HCl}=\dfrac{10\cdot21.9\%}{36.5}=0.06\left(mol\right)\)
\(AO+2HCl\rightarrow ACl_2+H_2O\)
\(0.03........0.06\)
\(M=\dfrac{2.4}{0.03}=80\left(\dfrac{g}{mol}\right)\)
\(\Rightarrow A=64\)
\(CuO\)
Câu 2 :
$n_{CuO} = \dfrac{1,6}{80} = 0,02(mol)$
$n_{H_2SO_4} = \dfrac{100.20\%}{98} = \dfrac{10}{49}$
$CuO + H_2SO_4 \to CuSO_4 + H_2O$
$n_{CuO} < n_{H_2SO_4}$ nên $H_2SO_4 dư
Theo PTHH :
$n_{CuSO_4} = n_{H_2SO_4\ pư} = n_{CuO} = 0,02(mol)$
$m_{dd} = 1,6 + 100 = 101,6(gam)$
Vậy :
$C\%_{CuSO_4} = \dfrac{0,02.160}{101,6}.100\% = 3,15\%$
$C\%_{H_2SO_4\ dư} = \dfrac{100.20\% - 0,02.98}{101,6}.100\% = 17,6\%$

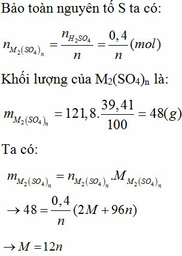

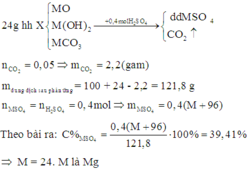
c