Cho 5,6 Fe vào bình dung dịch chưa 14,7g H2SO4
a) Tính thể tích H2 tối ta thu được (đktc)
b) Tính khối lượng FeSO4 tạo thành
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a.b.\(n_{Fe}=\dfrac{5,6}{56}=0,1mol\)
\(Fe+H_2SO_4\left(l\right)\rightarrow FeSO_4+H_2\)
0,1 0,1 0,1 ( mol )
\(m_{FeSO_4}=0,1.152=15,2g\)
\(V_{H_2}=0,1.22,4=2,24l\)
c.\(PbO+H_2\rightarrow\left(t^o\right)Pb+H_2O\)
0,1 0,1 ( mol )
\(m_{Pb}=0,1.207=20,7g\)
nFe = 5,6 : 56 = 0,1 (mol)
pthh : Fe + H2SO4 -> FeSO4 + H2
0,1 0,1 0,1
mFeSO4 = 0,1 . 152 = 15,2 (G)
VH2 = 0,1 . 22,4 = 2,24 (L)
pthh : PbO + H2 -t-> Pb + H2O
0,1 0,1
mPb = 207 . 0,1 = 20,7 (G)

\(n_{Fe}=\dfrac{5.6}{56}=0.1\left(mol\right)\)
\(n_{HCl}=\dfrac{10.95}{36.5}=0.3\left(mol\right)\)
\(Fe+2HCl\rightarrow FeCl_2+H_2\)
Lập tỉ lệ :
\(\dfrac{0.2}{1}>\dfrac{0.3}{2}\Rightarrow Fedư\)
Khi đó :
\(n_{FeCl_2}=n_{H_2}=\dfrac{1}{2}\cdot n_{HCl}=\dfrac{1}{2}\cdot0.3=0.15\left(mol\right)\)
\(m_{FeCl_2}=0.15\cdot127=19.05\left(g\right)\)
\(V_{H_2}=0.15\cdot22.4=3.36\left(l\right)\)
\(n_{Fe}=\dfrac{5,6}{56}=0,1\left(mol\right)\\ n_{HCl}=\dfrac{10,95}{36,5}=0,3\left(mol\right)\\ PTHH:Fe+2HCl\rightarrow FeCl_2+H_2\\ Vì:\dfrac{0,1}{1}< \dfrac{0,3}{2}\\ \Rightarrow HCldư\\ \Rightarrow n_{FeCl_2}=n_{Fe}=n_{H_2}=0,1\left(mol\right)\\ \Rightarrow m_{FeCl_2}=127.0,1=12,7\left(g\right)\\ V_{H_2\left(đktc\right)}=0,1.22,4=2,24\left(l\right)\)

a) nFe= 5,6/56=0,1(mol)
nHCl=10,95/36,5=0,3(mol)
PTHH: Fe + 2 HCl -> FeCl2 + H2
Ta có: 0,3/2 > 0,1/1
=> HCl dư, Fe hết, tính theo nFe
-> nH2=nFeCl2=nFe=0,1(mol)
=> V(H2,đktc)=0,1.22,4=2,24(l)
mFeCl2=0,1.127=12,7(g)

a.
n Fe=28562856=0,5 (mol)
Fe+H2SO4→FeSO4+H2↑
0,5→0,5 0,5 0,5 (mol)
b.
V H2(đktc)=0,5.22,4=11,2 (l)
c.
m HCl=0,5.36,5=18,25 (g)
d.
m FeSO4=0,5.152=76 (g)

\(n_{H2}=\dfrac{5,6}{22,4}=0,25\left(mol\right)\)
Pt : \(Fe+H_2SO_4\rightarrow FeSO_4+H_2|\)
1 1 1 1
0,25 0,25 0,25
a) \(n_{Fe}=\dfrac{0,25.1}{1}=0,25\left(mol\right)\)
⇒ \(m_{Fe}=0,25.56=14\left(g\right)\)
b) \(n_{H2SO4}=\dfrac{0,25.1}{1}=0,25\left(mol\right)\)
200ml = 0,2l
\(C_{M_{ddH2SO4}}=\dfrac{0,25}{0,2}=1,25\left(M\right)\)
Chúc bạn học tốt

Đáp án D
Trong dung dịch axit, ta có :
n Cl - = n HCl = 0 , 3 mol
n SO 4 2 - = n H 2 SO 4 = 0 , 15 mol
Sơ đồ phản ứng :

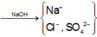
Cho NaOH vào X để thu được kết tủa lớn nhất thì dung dịch sau phản ứng chỉ còn các ion Na + , Cl - và SO 4 2 - .
Áp dụng bảo toàn điện tích trong dung dịch sau phản ứng và bảo toàn nguyên tố Na, ta có :
n NaOH = n Na + = n Cl - + 2 n SO 4 2 - = 0,6 mol
→ V dd NaOH 1 M = 0,6 lit = 600ml

`a)`
`Fe + H_2 SO_4 -> FeSO_4 + H_2`
`0,4` `0,4` `0,4` `(mol)`
`n_[Fe]=[22,4]/56=0,4(mol)`
`b)m_[FeSO_4]=0,4.152=60,8(g)`
`c)V_[H_2]=0,4.22,4=8,96(l)`
\(n_{Fe}=\dfrac{5.6}{56}=0.1\left(mol\right)\)
\(n_{H_2SO_4}=\dfrac{14.7}{98}=0.15\left(mol\right)\)
\(Fe+H_2SO_4\rightarrow FeSO_4+H_2\)
\(1...........1\)
\(0.1............0.15\)
\(LTL:\dfrac{0.1}{1}< \dfrac{0.15}{1}\Rightarrow H_2SO_4dư\)
\(V_{H_2}=0.1\cdot22.4=2.24\left(l\right)\)
\(m_{FeSO_4}=0.1\cdot152=15.2\left(g\right)\)
\(n_{Fe}=0,1\left(mol\right)\); \(n_{H2SO4}=0,15\left(mol\right)\)
PTHH: \(Fe+H_2SO_4\rightarrow FeSO_4+H_2\uparrow\)
LTL: 0,1 < 0,15 (mol)
Pư: 0,1→ 0,1 → 0,1 → 0,1 (mol)
Sau pư: 0 : 0,05 (mol)
a) \(V_{H_2\left(đktc\right)}=n.22,4=0,1.22,4=2,24\left(l\right)\)
b) \(m_{FeSO_4}=n.M=0,1.152=15,2\left(g\right)\)