

Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.



Liên kết đơn C – C có gồm 1 liên kết σ có năng lượng là 368 kJ mol-1.
Liên kết đôi C = C gồm 1 liên kết σ và liên kết π có năng lượng là 636 kJ mol-1.
=> Năng lượng của liên kết π là: 636 – 368 = 268 (kJ mol-1)
Vì năng lượng của liên kết σ (368 kJ mol-1) lớn hơn năng của liên kết π (268 kJ mol-1) nên khi phân tử tham gia phản ứng, liên kết π dễ bị bẻ gãy hơn.

1. Trong 1000 m 3 khí thiên nhiên có 850 m 3 C H 4
2 C H 4 → 1500 ° C C 2 H 2 + 3 H 2
CH ≡ CH + HCl → 150 - 200 ° C , H g C l 2 C H 2 = C H - C l
Khối lượng vinyl clorua thu được (nếu hiệu suất các quá trình là 100%) là:
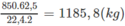
Với hiệu suất cho ở đầu bài, khối lượng vinyl clorua là:
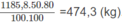
2. Nhiệt lượng cần dùng để làm nóng 100 lít nước từ 20 ° C lên 100 ° C :
100.4,18.(100 - 20) = 33440 (kJ)
Vì 20% nhiệt lượng đã toả ra môi trường nên nhiệt lượng mà khí thiên nhiên cần cung cấp phải là :
Đặt số mol C 2 H 6 tà x thì số mol C H 4 là 85. 10 - 1 x.
Ta có 1560x + 88085. 10 - 1 x = 41800
x = 462. 10 - 2
Thể tích khí thiên nhiên cần dùng:
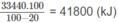

Câu 1:
a ,\(C_2H_2+2AgNO_3+2NH_3\rightarrow Ag_2C_2+NH_4NO_3\)
0,04__________________________________0,04
\(n_{kt}=0,04\left(mol\right)\)
\(\Rightarrow n_{C3H6}=0,05\left(mol\right)\)
% m(C2H2) = 0,04.26/3,14 . 100% =33,12 %
=> % m(C3H6) = 66 ,88%
b, 9,42 g sẽ có 0,12 mol C2H2 và 0,15 mol C3H6
Tổng số lk pi = 0,12.2+0,15=0,39 (mol)
V = 0,39 (l) = 390 (ml)

1. Đổi thể tích hỗn hợp khí trong bình trước phản ứng về đktc:
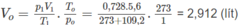
Số mol các chất trong bình trước phản ứng là:
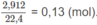
Số mol O2 = 0,1 (mol) ⇒ Số mol 2 ancol = 0,13 - 0,1 = 0,03 (mol).
Khi 2 ancol cháy :
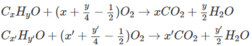
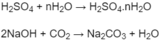
Số mol
H
2
O
là: 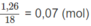
Số mol
C
O
2
là: 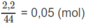
Theo định luật bảo toàn khối lượng :

= 3,2 + 0,03.16 - 0,07.16 - 0,05.32 = 0,96 (g).
Số mol
O
2
còn dư: 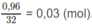
Tổng số mol các chất trong bình sau phản ứng :
0,07 + 0,05 + 0,03 = 0,15 (mol).
Thể tích của 0,15 mol khí ở đktc là: V O = 0,15.22,4 = 3,36 (lít).
Thực tế, sau phản ứng V = 5,6 lít.
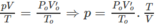
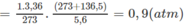
2. Giả sử C x H y O có PTK nhỏ hơn C x ' H y ' O ; như vậy số mol C x H y O sẽ là O 2 và số mol C x ' H y ' O là 0,01.
Số mol C O 2 sẽ là 0,02x + 0,01x' = 0,05 (mol) hay 2x + x' = 5.
x và x' là số nguyên: x = 1 ; x' = 3
hoặc x = 2; x' = 1
Cặp x = 2; x' = 1 loại vì trái với điều kiện: C x H y O có PTK nhỏ hơn C x ' H y ' O
Vậy, một ancol là C H 4 O và chất còn lại C 3 H y ' O .
Số mol H 2 O là 0,02.2 + 0,01.(y′/2) = 0,07 (mol).
⇒ y' = 6 ⇒ Ancol còn lại là C 3 H 6 O .
% về khối lượng của C H 4 O hay C H 3 - O H (ancol metylic) :

% về khối lượng của C 3 H 6 O hay C H 2 = C H - C H 2 - O H (a- Oncol anlylic): 100,00% - 52,46% = 47,54%.

1. Giả sử hỗn hợp A có X mol C n H 2 n + 2 và y mol C m H 2 m + 2 :
(14n + 2)x + (14m + 2)y = 1,36 ⇒ 14(nx + my) + 2(x + y) = 1,36 (1)
Khi đốt hỗn hợp A:
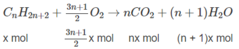
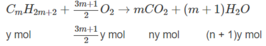
n C O 2 = n C a C O 3 = 0,09(mol)
⇒ nx + my = 0,09 (2)
Từ (1) và (2), tìm được x + y = 0,05.
Số mol O 2 trước phản ứng: n O 2 = 0,2(mol).
Tổng số mol khi trước phản ứng: 0,2 + 0,05 = 0,25 (mol).
Nếu ở đktc thì V O = 0,25.22,4 = 5,6 (lít).
Thực tế V 1 = 11,2 (lít)
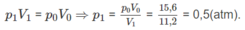
Số mol hơi nước: (n + 1)x + (m + 1)y = nx + my + x + y = 0,14
Số mol O 2 dự phản ứng:
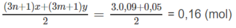
Số mol O 2 còn dư: 0,2 - 0,16 = 0,04 (mol).
Tổng số mol khí sau phản ứng: 0,09 + 0,14 + 0,04 = 0,27 (mol).
Nếu ở đktc thì V ' O = 0,27.22,4 = 6,048 (lít)
Thực tế V 2 = 11,20 (lít)
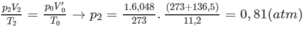
2) Nếu n < m thì x = 1,5y;
Vậy x = 0,03; y = 0,02
0,03n + 0,02m = 0,09 ⇒ 3n + 2m = 9
3n = 9 - 2m 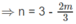
n và m nguyên dương nên m = 3 và n = 1.
C H 4 chiếm 60% thể tích hỗn hợp.
C 3 H 8 chiếm 40% thể tích hỗn hợp.