Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

PT: \(NH_3+H_2O⇌NH_4^++OH^-\)
Bđ: 0,1 0 0 (M)
Pư: x x x (M)
Cb: 0,1 - x x x (M)
Ta có:
\(\dfrac{\left[NH_4^+\right]\left[OH^-\right]}{\left[NH_3\right]}=K_c\) \(\Rightarrow\dfrac{x.x}{0,1-x}=1,74.10^{-5}\Rightarrow x\approx1,31.10^{-3}\left(M\right)\)
⇒ pH = 14 - (-log[OH-]) = 11,12

Vì muối CH3COONa là chất điện li mạnh nên ta có
![]()
Do đó sau quá trình trên trong dung dịch có nồng độ của ion CH3COO- là 0,1.
Xét cân bằng điện li: CH3COOH + H2O ⇌ CH3COO- + H3O+
Nồng độ ban đầu: 0,1 0,1 0
Nồng độ phân li: x(M) → x x
Nồng độ cân bằng: 0,1 – x 0,1 + x x
Thay các giá trị ở trạng thái cân bằng vào công thức tính hằng số điện li thì ta có
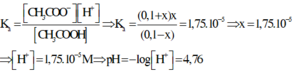
Đáp án D.

`100mL=0,1L`
`n_{H^+}=0,1.0,05.2+0,1.0,1=0,02(mol)`
`n_{SO_4^{2-}}=0,1.0,05=0,005(mol)`
`n_{OH^-}=0,1.0,2+0,1.0,1.2=0,04(mol)`
`n_{Ba^{2+}}=0,1.0,1=0,01(mol)`
`Ba^{2+}+SO_4^{2-}->BaSO_4`
Do `0,01>0,005->` Tính theo `SO_4^{2-}`
`n_{BaSO_4}=n_{SO_4^{2-}}=0,005(mol)`
`->m_↓=0,005.233=1,165(g)`
`H^{+}+OH^{-}->H_2O`
Do `0,02<0,04->OH^-` dư
`n_{OH^{-}\ pu}=n_{H^+}=0,02(mol)`
`->n_{OH^{-}\ du}=0,04-0,02=0,02(mol)`
Trong X: `[OH^-]={0,02}/{0,1+0,1}=0,1M`
`->pH=14-pOH=14+lg[OH^-]=13`

a, \(CH_3COOH⇌CH_3COO^-+H^+\)
Bđ: 0,1 0 0 (M)
Pư: x x x (M)
Cb: 0,1-x x x (M)
Có: \(K_c=\dfrac{\left[CH_3COO^-\right]\left[H^+\right]}{\left[CH_3COOH\right]}\Rightarrow1,8.10^{-5}=\dfrac{x.x}{0,1-x}\) \(\Rightarrow x\approx1,33.10^{-3}\)
⇒ pH = -log[H+] = 2,88
b, \(CH_3COONa⇌CH_3COO^-+Na^+\)
\(CH_3COO^-+H_2O⇌CH_3COOH+OH^-\)
→ MT base
c, \(n_{NaOH}=0,01.0,1=0,001\left(mol\right)\)
\(n_{CH_3COOH}=0,01.0,2=0,002\left(mol\right)\)
PT: \(NaOH+CH_3COOH\rightarrow CH_3COONa+H_2O\)
Xét tỉ lệ: \(\dfrac{0,001}{1}< \dfrac{0,002}{1}\), ta được CH3COOH dư.
Theo PT: \(n_{CH_3COOH\left(pư\right)}=n_{CH_3COONa}=n_{NaOH}=0,001\left(mol\right)\)
\(\Rightarrow n_{CH_3COOH\left(dư\right)}=0,002-0,001=0,001\left(mol\right)\)
→ Dd A gồm: CH3COONa: \(\dfrac{0,001}{0,02}=0,05\left(M\right)\) và CH3COOH: \(\dfrac{0,001}{0,02}=0,05\left(M\right)\)
\(CH_3COOH⇌CH_3COO^-+H^+\)
Bđ: 0,05 0,05 0 (M)
Pư: x x+0,05 x (M)
Cb: 0,05-x x+0,05 x (M)
\(\Rightarrow\dfrac{x\left(x+0,05\right)}{0,05-x}=1,8.10^{-5}\Rightarrow x\approx1,8.10^{-5}\)
⇒ pH = 4,74

Đáp án C
nH+ = 0,02 mol; nOH-= 0,04 mol
H+ + OH- → H2O
0,02 0,04
nOH- dư = 0,02 mol; [OH-] dư = 0,02/0,2 = 0,1M suy ra [H+] = 10-13 M suy ra pH = 13

Đáp án B
nH+ = 0,1 .2.0,05 + 0,1.0,1 =0,02
nOH- = 0,1.0,2 + 0,1.0,1.2 = 0,04
⇒ Trong dung dịch sau phản ứng có nOH- dư = 0,04 – 0,02 = 0,02 mol
V dd thu = 100 + 100 = 200ml
⇒ [OH-] = 0,1 ⇒ pH = 13
Đáp án B.
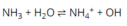
\(NH_3+H_2O⇌NH_4^++OH^-\)
Bđ: 0,05 0,1 0 (M)
Pư: x x+0,1 x (M)
Cb: 0,05-x x+0,1 x (M)
Có: \(\dfrac{\left[NH_4^+\right]\left[OH^-\right]}{\left[NH_3\right]}=K_c\) \(\Rightarrow\dfrac{\left(x+0,1\right).x}{0,05-x}=1,74.10^{-5}\Rightarrow x\approx8,7.10^{-6}\)
⇒ pH = 14 - (-log[OH-]) = 8,94