Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Chọn D
Cấu hình electron nguyên tử X: [He]2s22p5.
Cấu hình electron nguyên tử Y: [Ar]4s1
X là phi kim điển hình (nhóm VIIA) và Y là kim loại điển hình (nhóm IA) nên liên kết trong hợp chất tạo thành từ X và Y là liên kết ion.

Ta có ![]()
Y có số lớp e lớp ngoài cùng là 7 nên là 1 halogen.
Vậy lk giữa X và Y là XY: lk ion
Đáp án D

Chọn D
Cấu hình electron nguyên tử X: [He]2s22p2
Cấu hình electron nguyên tử Y: [Ne] 3s23p4
Ta có:
: X : + 2 : Y . . : → : Y .. : : X : : Y : ..
→ Hợp chất cộng hóa trị tạo thành từ X và Y là XY2.

Đáp án D
Cấu hình electron của nguyên tố X, Y lần lượt là 1s22s22p63s23px và 1s22s22p63sy.
Ta có: x + y = 7.
• TH1: y = 1 → x = 6
→ Cấu hình electron của nguyên tố X, Y lần lượt là 1s22s22p63s23p6 và 1s22s22p63s1.
Mà X không phải là khí hiếm → loại.
• TH2: y = 2 → x = 5
→ Cấu hình electron của nguyên tố X, Y lần lượt là 1s22s22p63s23p5 và 1s22s22p63s2.
Vậy điện tích hạt nhân của X, Y lần lượt là X (17+) và Y (12+) → Chọn D.

Đáp án B
X là nguyên tố nhóm IIA (hóa trị II)
Y là nguyên tố nhóm VA (hóa trị III)
Như vậy, công thức hợp chất phải là X3Y2


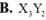

X: \(1s^22s^22p^63s^2\)
\(Y:1s^22s^22p^63s^23p^5\)
=> X cho 2e để đạt cấu hình bền vững, Y nhận 1e để đạt đến cấu hình bền vững
=> Hợp chất tạo bởi X,Y là XY2, liên kết ion