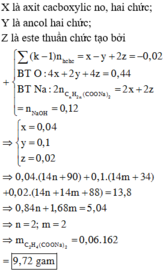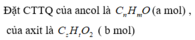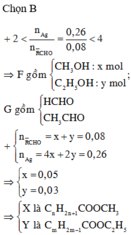Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Chọn đáp án A
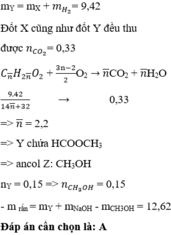
Đốt cháy 10,58g hỗn hợp X gồm 3 este đơn chức, mạch hở ta có: ![]() .
.
Mặt khác hidro hóa hoàn toàn 10,58 g hỗn hợp X cần 0,07 mol H2. Vậy 0,07 mol H2 chính là số mol liên kết π trong mạch Cacbon của 3 este.
![]()
Áp dụng định luật bảo toàn khối lượng cho phản ứng đốt cháy ta có:
![]()
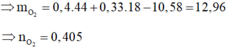
Áp dụng định luật bảo toàn nguyên tố O ta có:
![]()
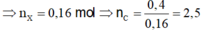
Vậy phải có 1 este có 2C. Vậy este đó phải là ![]() .
.
Theo đề bài ta thấy thủy phân Y trong NaOH chỉ thu được 1 ancol duy nhất, vậy ancol đó là CH3OH.
Vậy CT trung bình của 3 este sau khi hidro hóa là ![]() .
.
![]()
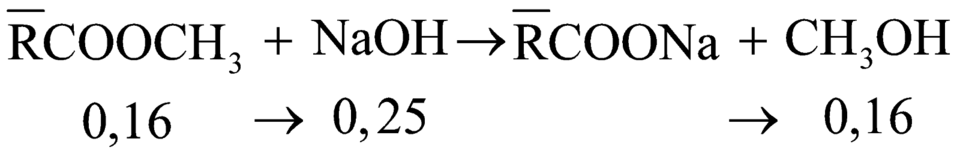
Áp dụng định luật bảo toàn khối lượng ta có:
![]()
![]()

Đáp án D
- Khi hidro hóa hoàn toàn hỗn hợp X thì mY = mX + mH2 = 16,08g
Giả sử đốt cháy hỗn hợp Y thì :
nCO2 = nH2O = 0,6 mol
Có : mX = mC + mH + mO => nO = 0,48 mol
=> nY = nCOO = 0,24 mol
=> Số C trung bình trong Y = 2,5 => X có chứa HCOOCH3
- Khi cho Y tác dụng với dung dịch NaOH thì :
Bảo toàn khối lượng : mrắn = mY + mNaOH – mCH3OH = 23,4g
(Với nCH3OH = nY)

Y có dạng CnH2nO2 (y mol)
mY = mX + mH2 = 10,58 + 0,07.2 = 10,72g
nCO2 = ny = 0,4
![]() y(14n + 32) = 10,72
y(14n + 32) = 10,72
14ny + 32y = 10,72
![]() 14.0,4 + 32y = 10,72
14.0,4 + 32y = 10,72 ![]() y = 0,16
y = 0,16
![]() Số C trung bình = 0,4/0,16 = 2,5
Số C trung bình = 0,4/0,16 = 2,5
![]() Có 1 chất là HCOOCH3
Có 1 chất là HCOOCH3
Ancol CH3OH
BTKL
0,16(14n + 32) + 0,25.40 = m + 0,16.32
m = 15,6
Chọn A.