Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Tham khảo!
+ Formaldehyde ứng dụng trong công nghiệp dệt, nhựa, chất dẻo, xây dựng, mỹ phẩm, keo dán, thuốc nổ, giấy than, mực máy photocopy… Ngoài ra, formaldehyde được sử dụng trong nông nghiệp và thuỷ sản.
+ Acetaldehyde được dùng nhiều trong tổng hợp hữu cơ. Ví dụ sản xuất acetic acid, acetic anhydride, butanol …
+ Acetone là dung môi tốt trong sản xuất tơ nhân tạo, thuốc súng không khói, dùng để pha loãng nhựa polyester và được sử dụng trong các chất tẩy rửa. Acetone là nguyên liệu để tổng hợp nhiều chất hữu cơ như chloroform, iodoform, methyl methacrylate, thuốc an thần sulfonal…

Formic aldehyde (HCHO) và acetic aldehyde (CH3CHO) là các aldehyde phân tử khối nhỏ có trạng thái khí ở nhiệt độ thường.

Tham khảo:
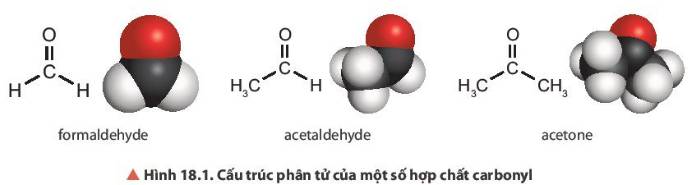
- Đặc điểm chung về cấu tạo của formaldehyde, acetaldehyde (aldehyde) và acetone (ketone): đều chứa nhóm carbonyl (>C=O).
- Hình dạng phân tử của formaldehyde và acetaldehyde:
+ Phân tử formaldehyde: gồm 1 nguyên tử carbon liên kết với 1 nguyên tử oxygen và 2 nguyên tử hydrogen, các nguyên tử đều nằm trên một mặt phẳng.
+ Phân tử acetaldehyde có 2 nguyên tử carbon liên kết với nhau, trong đó 1 nguyên tử carbon nằm ở tâm một hình tứ diện liên kết với 3 nguyên tử hydrogen, nguyên tử carbon còn lại liên kết với 1 nguyên tử oxygen và 1 nguyên tử hydrogen.
Hai phân tử trên có nhóm carbonyl, gồm nguyên tử carbon liên kết với nguyên tử oxygen bằng 1 liên kết σ bền và 1 liên kết π kém bền. Liên kết đôi C=O và 2 liên kết đơn nằm trên 1 mặt phẳng, góc liên kết khoảng 120°.

Formic aldehyde (HCHO) và acetic aldehyde (CH3CHO) là các aldehyde phân tử khối nhỏ có trạng thái khí ở nhiệt độ thường.

Do các phân tử ethanol có thể tạo liên kết hydrogen với nhau và với nước.

- Sử dụng thuốc thử Tollens hoặc Cu(OH)2 trong môi trường kiềm để phân biệt acetaldehyde và acetone
- Lí do sử dụng: acetone không có phản ứng với thuốc thử Tollens hoặc Cu(OH)2 trong môi trường kiềm.

Chọn phương án C.
Vì phân tử ethanol phân cực và có tạo liên kết hydrogen với phân tử nước.

Gọi công thức phân tử của acetone là: \({\rm{ }}{{\rm{C}}_{\rm{x}}}{{\rm{H}}_{\rm{y}}}{{\rm{O}}_z}\)
\({\rm{\% }}{{\rm{m}}_{\rm{H}}}{\rm{ = 100\% - (62,07\% + 27,59\% ) = 10,34\% }}\)
Từ phổ khối lượng, ta có M = 58 (amu)
\(\begin{array}{l}{\rm{x = }}\frac{{{\rm{\% }}{{\rm{m}}_{\rm{C}}}}}{{{\rm{12}}}} \times \frac{{\rm{M}}}{{{\rm{100}}}}{\rm{ = }}\frac{{62,07}}{{{\rm{12}}}} \times \frac{{58}}{{{\rm{100}}}} \approx 3\\{\rm{y = }}\frac{{{\rm{\% }}{{\rm{m}}_{\rm{H}}}}}{{\rm{1}}} \times \frac{{\rm{M}}}{{{\rm{100}}}}{\rm{ = }}\frac{{10,34}}{{\rm{1}}} \times \frac{{58}}{{{\rm{100}}}} \approx 6\\{\rm{z = }}\frac{{{\rm{\% }}{{\rm{m}}_{\rm{O}}}}}{{{\rm{16}}}} \times \frac{{\rm{M}}}{{{\rm{100}}}}{\rm{ = }}\frac{{27,59}}{{{\rm{16}}}} \times \frac{{58}}{{{\rm{100}}}} \approx 1{\rm{ }}\end{array}\)
Công thức phân tử của acetone là \({{\rm{C}}_3}{{\rm{H}}_6}{\rm{O}}\)

Hợp chất carbonyl là các hợp chất hữu cơ trong phân tử có nhóm chức carbonyl. Nhóm chức carbonyl có trong aldehyde, ketone…

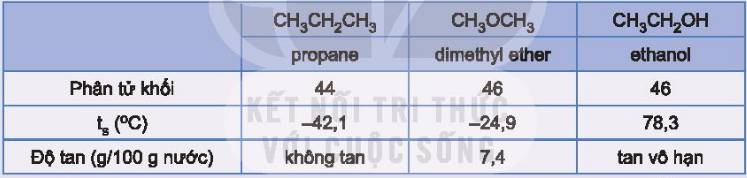
Vì các hợp chất carbonyl mạch ngắn tan tốt trong nước nhờ tạo liên kết hydrogen với nước và khi số nguyên tử carbon trong gốc hydrocarbon tăng, khả năng tan của hợp chất carbonyl giảm xuống.