Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

phần 2 bài 24 hóa 8 là sách lấy ví dụ CH4 + O2 để cho thấy O2 có tác dụng với hợp chất thôi bn, chứ k phải hợp chất nào + O2 cũng sinh ra nước đâu
còn tùy chứ
VD như các pư của hchc, Fe(OH)2, H2S, ... + O2 sinh ra sản phẩm trong đó có H2O đó, cái này phải học thuộc PTHH thôi bn :)

THAM KHẢO
Quang hợp là một ví dụ về phản ứng hóa học thu nhiệt. Trong quá trình này, thực vật sử dụng năng lượng từ mặt trời để chuyển carbon dioxide và nước thành glucose và oxy. Phản ứng này cần 15MJ năng lượng (ánh sáng mặt trời) cho mỗi kg glucozơ được tạo ra:
ánh sáng mặt trời + 6CO 2 (g) + H 2 O (l) = C 6 H 12 O 6 (aq) + 6O 2 (g)
Các ví dụ khác về quá trình thu nhiệt bao gồm:
Hòa tan amoni clorua trong nướcBẻ khóa ankanSự tổng hợp hạt nhân của các nguyên tố nặng hơn niken trong các ngôi saoNước lỏng bay hơiBăng tanMột ví dụ về phản ứng tỏa nhiệt là hỗn hợp natri và clo tạo ra muối ăn. Phản ứng này tạo ra 411 kJ năng lượng cho mỗi mol muối được tạo ra:
Na (s) + 0,5Cl 2 (s) = NaCl (s)
Các ví dụ khác về quá trình tỏa nhiệt bao gồm:
Các phản ứng nhiệt nhômPhản ứng trung hòa (ví dụ: trộn axit và bazơ để tạo thành muối và nước)Hầu hết các phản ứng trùng hợpĐốt cháy nhiên liệuHô hấpSự phân hạch hạt nhânĂn mòn kim loại (phản ứng oxy hóa)Hòa tan một axit trong nước– Dấu hiệu để nhận biết một phản ứng hóa học là có chất mới xuất hiện (khác với chất phản ứng). Chất mới tạo thành có thể nhận biết qua màu sắc, trạng thái, sự tỏa nhiệt, phát sáng…
Ví dụ:
Cho mẩu sắt đã nung đỏ vào bình chứa oxi thấy phản ứng cháy sáng mạnh và tỏa nhiều nhiệt → phản ứng có xảy ra.

\(n_{FeO\left(bđ\right)}=\dfrac{2.16}{72}=0.03\left(mol\right)\)
\(m_O=2.16-1.84=0.32\left(g\right)\)
\(n_O=\dfrac{0.32}{16}=0.02\left(mol\right)\)
\(n_{H_2}=n_{H_2O}=n_O=0.02\left(mol\right)\)
\(\Rightarrow n_{FeO}=0.02\left(mol\right)\)
\(V_{H_2}=0.02\cdot22.4=0.448\left(l\right)\)
\(H\%=\dfrac{0.02}{0.03}\cdot100\%=66.67\%\)

a)
$2KMnO_4 \xrightarrow{t^o} K_2MnO_4 + MnO_2 + O_2$
b) $n_{KMnO_4} = \dfrac{79}{158} = 0,5(mol)$
Theo PTHH : $n_{O_2} = \dfrac{1}{2}n_{KMnO_4} = 0,25(mol)$
$\Rightarrow V_{O_2} = 0,25.22,4 = 5,6(lít)$
c) $n_P = \dfrac{3,1}{31} = 0,1(mol)$
$4P + 5O_2 \xrightarrow{t^o} 2P_2O_5$
Ta thấy : $n_P : 4 < n_{O_2} :5$ nên $O_2$ dư
$n_{P_2O_5} = \dfrac{1}{2}n_P = 0,05(mol)$
$m_{P_2O_5} = 0,05.142 = 7,1(gam)$

Dùng quỳ tím là cách đơn giản nhất nha em! Nếu quỳ tím hoá đỏ thì dung dịch cần xác định là dd axit, ngược lại quỳ tím hoá xanh dung dịch cần xác định là dd bazo

a) PTHH:
\(4CO+Fe_3O_4\rightarrow3Fe+4CO_2\left(1\right)\)
\(3H_2+Fe_2O_3\rightarrow2Fe+3H_2O\left(2\right)\)
b) Theo PTPƯ trên ta có:
Muốn khử 1 mol \(Fe_3O_4\) cần 4 mol CO
Muốn khử 0,2 mol \(Fe_3O_4\) cần x mol CO
\(\Rightarrow x=0,2.4=0,8\left(mol\right)\)
\(V_{CO}=0,8.22,4=17,92\left(l\right)\)
Muốn khử 1 mol \(Fe_2O_3\) cần 3 mol H2
Muốn khử 0,2 mol \(Fe_2O_3\) cần y mol H2
\(\Rightarrow y=0,2.3=0,6\left(mol\right)\)
\(V_{H_2}=0,6.22,4=13,44\left(l\right)\)
c) (1): \(n_{Fe}=3n_{Fe_3O_4}=3.0,2=0,6\left(mol\right)\)
\(m_{Fe}=0,6.56=33,6\left(g\right)\)
(2): \(n_{Fe}=2n_{Fe_2O_3}=2.0,2=0,4\left(mol\right)\)
\(m_{Fe}=0,4.56=22,4\left(g\right)\)

1)
Theo đề bài ta có :
dhh/H2 = 14,75
=> \(\overline{M}_{hh}\) = 29,5 (g/mol)
Gọi nO2 = x (mol) ; nN2 = y (mol)
=> mO2 = 32x (g)
mN2 = 28y (g)
=> \(\overline{M}_{hh}\) = \(\dfrac{32x+28y}{x+y}\)
=> 29,5x + 29,5y = 32x + 28y
=> 1,5y = 2,5x
=> \(\dfrac{x}{y}=\dfrac{1,5}{2,5}=\dfrac{3}{5}\)
=> \(\dfrac{V_{O2}}{V_{N2}}=\dfrac{3}{5}\)
2)
PTHH:
A + O2 ---> CO2 + H2O
Trong A chắc chắn có C và H :
số mol CO2 = 0.3 mol
=> nC = 0.3 ; nO = 0.6
Số mol H2O = 0.4 mol
=> nH = 0.8 ; nO = 0.4
Số mol O2 = 0.45 mol
=> nO = 0.9
Tổng số mol Nguyên Tử O trong Sản Phẩm là :
0.6 + 0.4 =1 > 0.9
Vậy là Trong A có Nguyên tố O
1 - 0.9 = 0.1 mol
Coi Công thức A : CxHyOz thì ta có tỉ lệ
x : y : z = 0.3 : 0.8 : 0.1 = 3 : 8 :1
Vậy Công thức A là : C3H8O
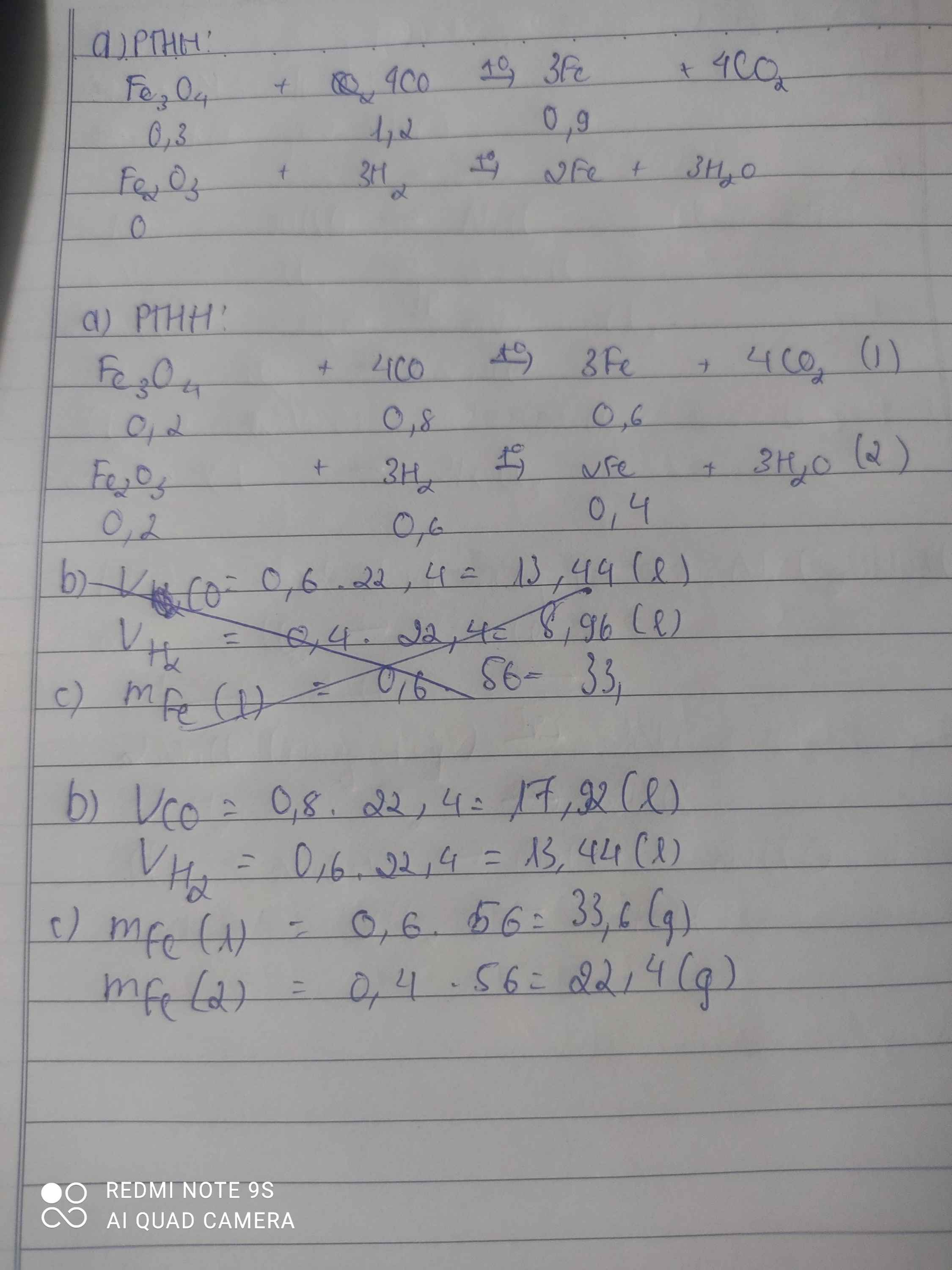
khi bạn học thuộc nha kẹo cao su vì cách đó sẽ giúp não bạn thư giãn và học giỏi hơn
rõ ik