Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

![]() Hỗn hợp anken hết trước, hiệu suất tính theo anken
Hỗn hợp anken hết trước, hiệu suất tính theo anken
Ta có: ![]() (vì n = pV/RT suy ra n tỉ lệ thuận với p)
(vì n = pV/RT suy ra n tỉ lệ thuận với p)
(trong đó n1, p1 là số mol và áp suất hỗn hợp lúc đầu, n2, p2 là số mol, áp suất hỗn hợp lúc sau)
![]()
Số mol hỗn hợp sau:
![]()
Số mol khí giảm
![]()
Vậy hiệu suất ![]()
Đáp án B.

Trong cùng một điều kiện nhiệt độ, thể tích bình không thay đổi thì tỉ lệ áp suất chính là tỉ lệ số mol. Suy ra ta có:

Áp dụng định luật bảo toàn khối lượng ta có
![]()
Đáp án B

Đáp án D.
Ban đầu: nhỗn hợp= PV/RT= 56.200/0,082.273= 500 mol
→nN2=100 mol, nH2= 400 mol

Sau khi phản ứng xảy ra đưa về 00C thì áp suất trong bình giảm 10% so với áp suất ban đầu
→Số mol khí cũng giảm 10%
→nkhí sau pứ= 500- 10%.500= 450 mol
Mà nkhí sau pứ= (100-x)+ (400-3x)+2x= 450
→x=25 mol
→H= (x/100).100%=25%
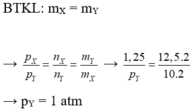

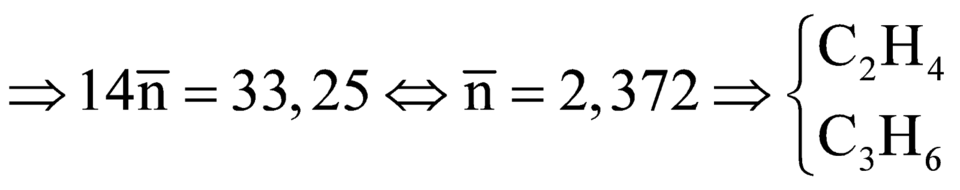
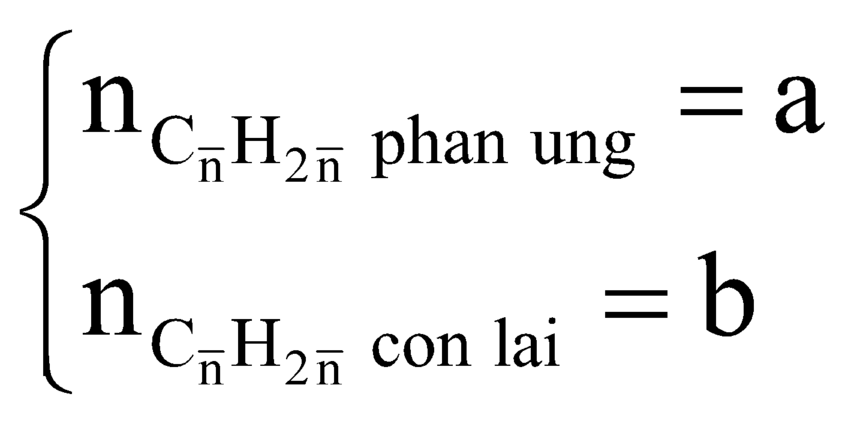
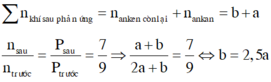

Đáp án A
Đặt nC2H4 ban đầu = x mol; nH2 = y mol.
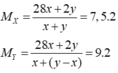
Ta có MY = 18 → H2 dư; hhY gồm C2H6 và H2 dư.
Theo BTKL: mX = mY = 28x + 2y gam.
→ y = 5x → hhY gồm x mol C2H6 và 4x mol H2.