Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

\(M_X = 18.2 = 36(đvC)\)
X gồm CO2,CO
Ta có :
\(44n_{CO_2} + 28n_{CO} = 36(n_{CO_2} + n_{CO})\\ \Rightarrow 8n_{CO_2} = 8n_{CO}\\ \Rightarrow n_{CO_2} = n_{CO}\)
\(CO_2 + Ca(OH)_2 \to CaCO_3 + H_2O\)
Theo PTHH :
\(n_{CO} = n_{CO_2} = n_{CaCO_3} = \dfrac{20}{100} = 0,2(mol)\)
\(C + O_2 \xrightarrow{t^o} CO_2\\ 2C + O_2 \xrightarrow{t^o} 2CO\\ n_{O_2} = n_{CO_2} + \dfrac{n_{CO}}{2} = 0,3(mol)\\ \Rightarrow V = 0,3.22,4 = 6,72(lít)\)
\(\)

\(n_{Br_2}=0,3.2,5=0,75\left(mol\right)\)
PTHH: SO2 + 2H2O + Br2 ---> H2SO4 + 2HBr
0,75<------------0,75
MA = 1,6.28 = 44,8 (g/mol)
O2 dư tác dụng với S thì sau phản ứng chứa O2 và SO2
Áp dụng sơ đồ đường chéo đối với A:
\(\dfrac{n_{SO_2}}{n_{O_2}}=\dfrac{V_{SO_2}}{V_{O_2}}=\dfrac{44,8-32}{64-44,8}=\dfrac{2}{3}\)
\(\rightarrow n_{O_2}=\dfrac{3}{2}.0,75=1,125\left(mol\right)\)
PTHH: S + O2 --to--> SO2
0,75<-0,75<-----0,75
=> \(\left\{{}\begin{matrix}m=0,75.32=24\left(g\right)\\V=\left(1,125+0,75\right).22,4=42\left(l\right)\end{matrix}\right.\)

\(n_{Mg}=\dfrac{8,4}{24}=0,35\left(mol\right)\)
PTHH:
\(2Mg+O_2\xrightarrow[]{t^o}2MgO\\
MgO+2HCl\rightarrow MgCl_2+H_2O\\
Mg+2HCl\rightarrow MgCl_2+H_2\)
ĐLBTKL: \(m_{O_2}=m_X-m_{Mg}=10-8,4=1,6\left(g\right)\)
\(\Rightarrow n_{O_2}=\dfrac{1,6}{32}=0,05\left(mol\right)\)
Quá trình oxi hóa - khử:
\(\overset{0}{Mg}\rightarrow\overset{+2}{Mg}+2e\)
\(\overset{0}{O_2}+4e\rightarrow2\overset{-2}{O}\)
\(2\overset{+1}{H}+2e\rightarrow H_2\)
\(\xrightarrow[]{BTelectron}2n_{Mg}=4n_{O_2}+2n_{H_2}\)
\(\Rightarrow n_{H_2}=\dfrac{0,35.2-0,05.4}{2}=0,25\left(mol\right)\)
`=> V = 0,25.22,4 = 5,6 (l)`

A + H2SO4 → Hỗn hợp khí ⇒ Fe dư; khí Y gồm: H2 ( x mol) và H2S (y mol)
⇒ x + y = 0,1 mol (1)
Bảo toàn S: nH2S = nFeS = nS = y mol
nFe dư = nH2 = x
Bảo toàn Fe: nFe = nFeS + nFe dư = x + y
mX = 56(x + y ) + 32y = 7,2g (2)
Từ (1)(2) ⇒ x = 0,05 mol; y = 0,05 mol
MY = mY : nY = (0,05.2 + 0,05.34) : 0,1 = 18 ⇒ dY/H2 = 9
Gọi \(\left\{{}\begin{matrix}n_{Fe}=a\left(mol\right)\\n_{FeS}=b\left(mol\right)\end{matrix}\right.\left(đk:a,b>0\right)\)
TH1: S dư
Vậy toàn bộ lượng khí sinh ra là H2S
\(d_{Y\text{/}H_2}=d_{H_2S\text{/}H_2}=\dfrac{34}{2}=17\)
TH2: Fe dư
\(n_{khí}=\dfrac{2,24}{22,4}=0,1\left(mol\right)\)
Bảo toàn KL: \(m_A=m_X=7,2\left(g\right)\)
PTHH:
\(Fe+2HCl\rightarrow FeCl_2+H_2\uparrow\)
a----------------------------->a
\(FeS+2HCl\rightarrow FeCl_2+H_2S\uparrow\)
b-------------------------------->b
Ta có hệ phương trình: \(\left\{{}\begin{matrix}56a+88b=7,2\\a+b=0,1\end{matrix}\right.\)
\(\Leftrightarrow a=b=0,05\left(TM\right)\)
\(M_Y=\dfrac{0,05.\left(2+34\right)}{0,1}=18\left(g\text{/}mol\right)\\ \rightarrow d_{Y\text{/}H_2}=\dfrac{18}{2}=9\)

Gọi \(\left\{{}\begin{matrix}n_{H_2}=a\left(mol\right)\\n_{CO_2}=b\left(mol\right)\end{matrix}\right.\) => \(a+b=\dfrac{8,96}{22,4}=0,4\left(mol\right)\)
=> \(\overline{M}_X=\dfrac{2a+44b}{a+b}=2.6,25=12,5\left(g/mol\right)\)
=> a = 0,3; b = 0,1
PTHH: Fe + 2HCl --> FeCl2 + H2
0,3<--0,6<------0,3<---0,3
CaCO3 + 2HCl --> CaCl2 + CO2 + H2O
0,1<----0,2<------0,1<----0,1
CuO + 2HCl --> CuCl2 + H2O
x--->2x------->x
mrắn (sau pư) = 0,3.127 + 0,1.111 + 135x = 62,7
=> x = 0,1 (mol)
mA = 0,1.80 + 0,3.56 + 0,1.100 = 34,8 (g)
mHCl = (0,6 + 0,2 + 0,2).36,5 = 36,5 (g)
=> \(m'=\dfrac{36,5.100}{14,6}=250\left(g\right)\)

Xét P2 : Chỉ có Al phản ứng với NaOH => nAl.3 = 2nH\(_2\) ( Bảo toàn e)
=> nAl = 0,1 mol
Xét P1 : Fe và Al phản ứng với HCl đặc => 2nFe + 3nAl = 2nH\(_2\)
=> nFe = 0,1 mol
=> Trong mỗi phần thì có : mCu = \(\dfrac{1}{2}.10-27.0,1-56.0,1=1,7\left(g\right)\)
\(\%m_{Cu\left(X\right)}=\%m_{Cu\left(1/2X\right)}=17\%\)


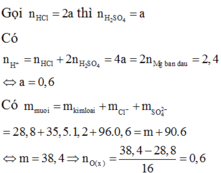
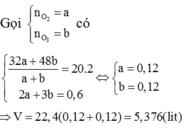
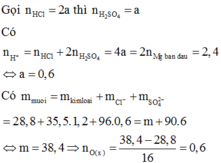
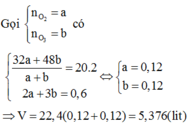
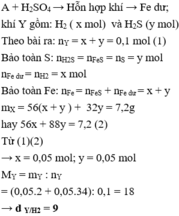
Sau khi phóng tia lửa điện thì O2 thành O3 à:v?