Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

3VN2 < VH2 ⇒ H% được tính theo N2
N2 + 3H2 → 2NH3
0,8 ← 1,6
⇒ H = 0,8 ÷ 4 × 100% = 20%
Đáp án C.

Đáp án B
![]()
Do 1 1 > 4 3 → Hiệu suất tính theo N 2
Đặt số mol N2 ban đầu là x mol
→ nH2 ban đầu= 4x mol;
Do hiệu suất phản ứng là 25% nên
nN2 pứ= 25%.x= 0,25x mol
![]()
Ban đầu x 4x mol
Phản ứng 0.25x 0.75x 0.5x mol
Sau pứ 0.75x 3.25x 0.5x mol
Sau phản ứng nNH3= 0,5x= 1,5 suy ra x=3 mol
→V= 22,4. (x+3x)= 22,4.4.3=268,8 lít

Chọn C
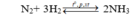
Giả sử phản ứng xảy ra với H = 100% → N 2 hết →Hiệu suất tính theo N 2 .
Đặt số mol N 2 ban đầu là x mol, n N 2 ban đầu = 4x mol;
Do hiệu suất phản ứng là 25% nên n N 2 pứ = 25%.x = 0,25x mol
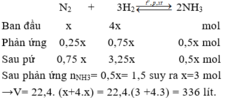

N2+ 3H2 ⇌ 2NH3
Ở cùng điều kiện thì tỉ lệ về thể tích chính là tỉ lệ về số mol
Do hiệu suất phản ứng là 25% nên
VN2 pứ= 4.25%= 1 lít; VH2 pứ= 12.25%= 3 lít;
VNH3 sinh ra= 2VN2 pứ= 2 lít
VN2 dư= 4-1=3 lít, VH2 dư= 12-3=9 lít
Hỗn hợp thu được sau phản ứng có thể tích là
V= VN2 dư+ VH2 dư+ VNH3 sinh ra= 3 +9+2=14 lít
Đáp án B

Đáp án A.
N2+ 3H2 ⇌ 2NH3
Ở cùng điều kiện thì tỉ lệ về thể tích chính là tỉ lệ về số mol
Do 4 1 < 14 3 →Hiệu suất tính theo N2
Đặt thể tích N2 phản ứng là x lít
→VH2 pứ= 3x lít, VNH3 sinh ra=2xlít
VN2 dư= 4-x (lít), VH2 dư= 14-3x (lít)
Sau phản ứng thu được N2 dư, H2 dư, NH3
Tổng thể tích khí thu được là
V khí= VH2 dư+ VN2 dư+ VNH3= 14-3x + 4-x+ 2x= 16,4
→ x=0,8 lít
→ H = v N 2 pu V N 2 bd · 100 % = 0 , 8 4 · 100 % = 20 %

Chọn đáp án C
Ta có phản ứng
1N2 + 3H2 ⇌ 2NH3
Hiệu suất tính theo N2 vì:  .
.
nN2 pứ = ![]()
⇒ Hpứ =![]()
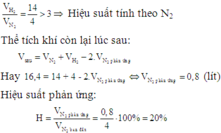
Giả sử các khí được đo ở điều kiện sao cho 1 mol khí có thể tích x lít
\(n_{NH_3}=\dfrac{2}{x}\left(mol\right)\)
\(n_{N_2}=\dfrac{4}{x}\left(mol\right)\)
\(n_{H_2}=\dfrac{10}{x}\left(mol\right)\)
PTHH: N2 + 3H2 --> 2NH3
\(\dfrac{3}{x}\)<------\(\dfrac{2}{x}\)
Xét tỉ lệ \(\dfrac{\dfrac{4}{x}}{1}>\dfrac{\dfrac{10}{x}}{3}\) => H% tính theo H2
=> \(H\%=\dfrac{\dfrac{3}{x}}{\dfrac{10}{x}}.100\%=30\%\)
=> B
C. 25%