Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án B
Trong toàn bộ quá trình chỉ có Al tăng số oxi hóa từ 0 lên +3 và N trong HNO3 giảm số oxi hóa từ +5 xuống +2. Áp dụng định luật bảo toàn mol electron, ta có:
3nAl = 3nNO => nNO = nAl=0,3 => V=6,72 (lít)

Đáp án D:
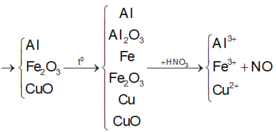
Tóm tắt theo sơ đồ:
rFeoOo t° _ Hòa tan hoàn toàn bằng HNO3

Như vậy, thực chất trong bài toán này chỉ có quá trình cho và nhận electron của nguyên tử Al và N.
Các quá trình nhường và nhận electron như sau:
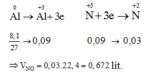

Đáp án D
Ta có: nA1 = 0,03 (mol)
Các phương trình phản ứng:
2Al + Fe2O3 → Al2O3 + 2Fe (1)
2Al + 3CuO → Al2O3 + 3Cu (2)
Gọi số mol Al tham gia phản ứng (1) là x, tham gia phản ứng (2) là y.
Theo (1): nFe = nAl = x (mol)
Theo (2): nCu = 3 2 nAl = 3 2 y (mol)
Fe + 4HNO3loãng → Fe(NO3)3 + NO + 2H2O (3)
3Cu + 8HNO3 loãng → 3Cu(NO3)2 + 2NO + 4H2O (4)
Theo (3): nNO/( 3) = nFe = x (mol).
Theo (4): nNO/(4) = 2 3 nCu = 2 3 . 3 2 y = y(mol)
⇒ nNO = x + y = 0,03 (mol) ⇒VNO = 0,03 x 22,4 = 0,672 (lit).

Giải thích:
nAl = 0,4 mol ; nFe3O4 = 0,15 mol
Giả sử H = x
![]()
Bd: 0,4 0,15
Pu: 0,4x 0,15x 0,2x 0,45x
Sau: 0,4 – 0,4x 0,45x
nH2 = 1,5nAl + nFe → 0,48 = 1,5(0,4 – 0,4x) + 0,45x
→ x = 0,8
→ H = 80%
Đáp án D

Đáp án B
Trong toàn bộ quá trình chỉ có Al tăng số oxi hóa từ 0 lên +3 và N trong HNO3 giảm số oxi hóa từ +5 xuống +2 và +4. Áp dụng định luật bảo toàn mol electron, ta có: