Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Do lấy dư 20% oxi so với lượng cần đốt cháy nên lượng oxi đã lấy là:


Tổng khối lượng CO2 và SO2 :
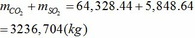
Chú ý:
Lượng O2 lấy dư 20% so với với lượng cần thiết => tính mol O2 chính xác

Dùng chăn hoặc cát phủ lên đám cháy xăng dầu ( trong trường hợp đám cháy nhỏ )
Vì dần nhẹ hơn nước dùng nước sẽ khiến đám cháy lan ra rộng hơn

Bài 1:
- Trích mỗi chất một ít làm mẫu thử.
- Dùng quỳ tím cho vào các dung dịch:
+ Hóa xanh -> dd Ba(OH)2 và dd NaOH (Nhóm I)
+ Hóa đỏ -> dd HCl và dd H2SO4 (Nhóm II)
- Nhỏ vài giọt dung dịch Na2SO4 vào các dd nhóm I, quan sát:
+ Có kết tủa trắng BaSO4 => dd Ba(OH)2
+ Không có kết tủa => dd NaOH
PTHH: Ba(OH)2 + Na2SO4 -> BaSO4 + 2 NaOH
- Nhỏ vài giọt dd BaCl2 vào nhóm II, quan sát:
+ Có kết tủa trắng BaSO4 => dd H2SO4
PTHH: H2SO4 + BaCl2 -> BaSO4 + 2 HCl
+ Không có kết tủa => dd HCl
Bài 3:
\(a.n_{H_2}=\dfrac{2,24}{22,4}=0,1\left(mol\right)\\ Fe+H_2SO_4\rightarrow FeSO_4+H_2\\ n_{Fe}=n_{H_2}=0,1\left(mol\right)\\ m_{Fe}=0,1.56=5,6\left(g\right)\\ \%m_{Fe}=\dfrac{5,6}{8,8}.100\approx63,636\%\\ \Rightarrow\%m_{Cu}\approx36,364\%\\ b.2Fe+6H_2SO_4\left(đặc,nóng\right)\rightarrow Fe_2\left(SO_4\right)_3+3SO_2+6H_2O\\ Cu+2H_2SO_4\left(đặc,nóng\right)\rightarrow CuSO_4+SO_2+2H_2O\\ n_{SO_2\left(tổng\right)}=\dfrac{3}{2}.n_{Fe}+n_{Cu}=\dfrac{3}{2}.0,1+\dfrac{8,8-5,6}{64}=0,2\left(mol\right)\\ V_{SO_2\left(đktc\right)}=0,2.22,4=4,48\left(l\right)\)

Bạn tham khảo
Dựa vào trạng thái của chúng, người ta phân chia thành 3 loại: rắn, lỏng và khí. Nhiên liệu rắn: gỗ, than mỏ, than gầy, than mỡ, than non, than bùn… → Chủ yếu được sử dụng làm nhiên liệu cho nhiều ngành công nghiệp như nhiệt điện, luyện kim, giấy, đun nấu và phân bón… Nhiên liệu lỏng: xăng, dầu hỏa, cồn đốt…

PTHH: \(C_2H_2+\dfrac{5}{2}O_2\xrightarrow[]{t^o}2CO_2+H_2O\)
\(C_2H_6+\dfrac{7}{2}O_2\xrightarrow[]{t^o}2CO_2+3H_2O\)
Ta thấy khi đốt axetilen, lượng nước giải phóng ra ít hơn so với đốt etan. Vì vậy lượng nước thoát ra làm nguội cũng ít hơn. Do đó đốt axetilen nhiệt độ cao hơn
PTHH :
`C_2H_2 + 5/2O_2` `->^{t^o} CO_2 + H_2O`
`C_2H_6 + 7/2O_2 ->^{t^o} CO_2 + 3H_2O`
Dựa vào PTHH ta thấy được lượng nước giải phóng của etan nhiều hơn của axetilen. Nên khi đốt axetilen có nhiệt độ cao hơn giúp cắt kim loại và làm đèn xì tốt hơn.