Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án C
2 dung dịch có thể tích bằng nhau ⇒ nOH-/ Ba(OH)2 = 2nH+/ HCl
H+ + OH- → H2O
0,2V 0,4V (mol)
Phản ứng : 0,2V → 0,2V (mol)
⇒ Trong dung dịch thu được có OH- dư
Trộn 2 dung dịch có cùng thể tích ⇒ [OH-] dư = 0,2 : 2 = 0,1M
⇒ pH = 13.
Đáp án C.

Đáp án C
nH+ = 0,02 mol; nOH-= 0,04 mol
H+ + OH- → H2O
0,02 0,04
nOH- dư = 0,02 mol; [OH-] dư = 0,02/0,2 = 0,1M suy ra [H+] = 10-13 M suy ra pH = 13

\(1.n_{cation}=0,1.0,6+0,05.0,4=0,08\left(mol\right)\\ C_{M\left(cation\right)}=\dfrac{0,08}{0,6+0,4}=0,08\left(M\right)\\ 2.n_{cation}=0,2.0,2+2.0,3.0,1=0,1mol\\ C_{M\left(cation\right)}=\dfrac{0,1}{0,2+0,3}=0,2\left(M\right)\)
Cation của H2SO4 là H+.
Đề yêu cầu tính tổng nồng độ, không phải tổng số mol.

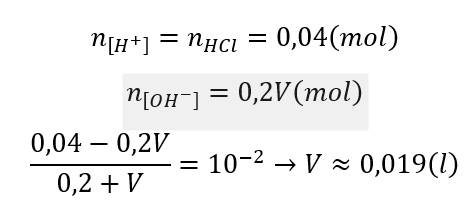
\(a.\)
\(pH=-log\left[H^+\right]=-log\left(0.1\right)=1\)
b.
\(pH=14+log\left[OH^-\right]=14+log\left(0.2\cdot2\right)=13.6\)