Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án B
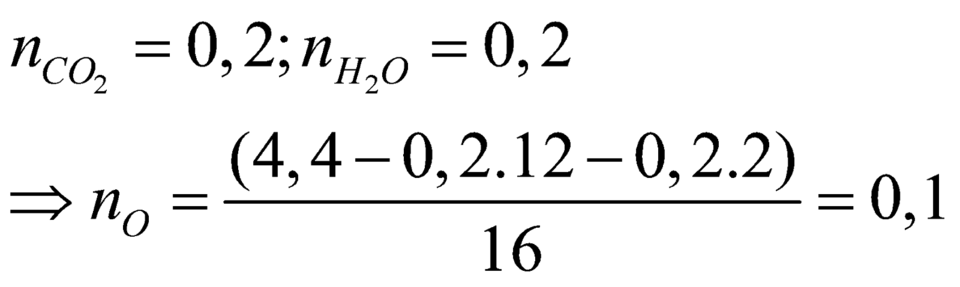
X tác dụng với NaOH sinh muối thì X là este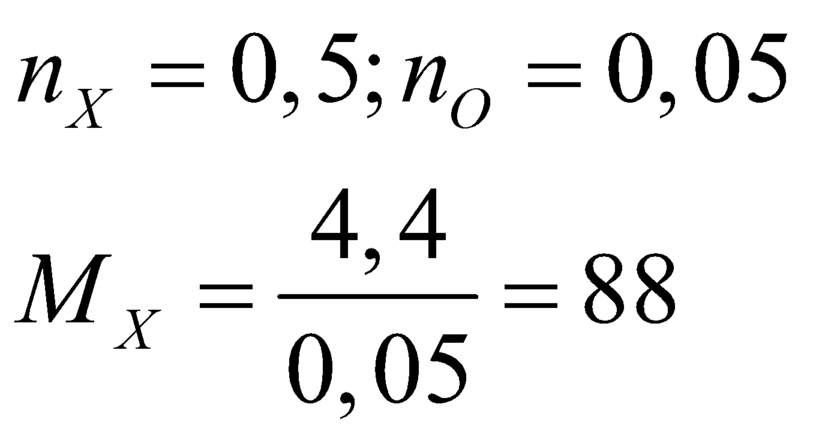
M có CTPT là ![]()
![]()
![]()
metyl propionat.

Đáp án: C
Giả sử công thức este là CnH2nO2
⇒
4
,
4
n
14
n
+
32
=
n
C
O
2
=
0
,
2
⇒
n
=
4
⇒
C
4
H
8
O
2

Giải thích:
nCO2 = 0,2 mol ; nH2O = 0,2 mol
Bảo toàn nguyên tố : nC = 0,2 ; nH = 0,4
=> mX = mC + mH + mO => nO = 0,1 mol
=> nC : nH : nO = 0,2 : 0,4 : 0,1 = 2 : 4 : 1
Vì X + NaOH tạo muối axit hữu cơ => X là este
=> C4H8O2.
TQ : RCOOR’ + NaOH -> RCOONa + R’OH
Vì : mmuối > meste => MR’ < MNa = 23 => R’ là CH3-
Vậy este là : C2H5COOCH3 (metyl propionat)
Đáp án A

E là este của với 3 axit X,Y,Z => X cũng là axit đơn chức
- Xét phản ứng đốt cháy M (X, E)
(Vì X có 2 liên kết pi => X có 1 pi trong gốc hidrocacbon và 1 pi trong nhóm COO)
=> E là este của X,Y,Z => số pi = pi(gốc R của X) + pi(COO) = 1 + 3 = 4)
Gọi công thức tổng quát của X : CnH2n-2O2 : u mol
E : CmH2m-6O6 : v mol
Khi đốt cháy: CnH2n-2O2 + (1,5n – 2)O2 → nCO2 + (n – 1)H2O
CmH2m-6O6 + (1,5m – 5)O2 → mCO2 + (m – 3)H2O
=> nCO2 – nH2O = nX + 3nE = u + 3v
- M phản ứng với NaOH : nNaOH = nCOO = nX + 3nE = u + 3v = 0,04 mol
Mặt khác mCO2 – mH2O = a – (a – 4,62) = 4,62g
=> nCO2 = 0,15 ; nH2O = 0,11 mol
Bảo toàn nguyên tố : nC(M) = nCO2 = 0,15 mol ; nH(M) = 2nH2O = 0,22 mol
nO(M) = 2nCOO(M) = 2nNaOH = 0,08 mol
=> mM = m = mC + mH + mO = 3,3g
- Xét 13,2g M + NaOH → Muối V thì số mol nguyên tố trong M gấp 13,2 : 3,3 = 4 lần
Và số mol NaOH + M cũng gấp 4 lần => nNaOH = 0,04.4 = 0,16 mol = nmuối V
( Phản ứng tổng quát : Este/Axit + NaOH → Muối + Ancol/H2O )
Khi đốt cháy tạo nCO2 = 0,4 mol
Bảo toàn Na : nNa2CO3 = ½ nNaOH = 0,08 mol
Có : mNa2CO3 + mH2O =14,24g => nH2O = 0,32 mol
Bảo toàn Oxi : nO(V) + 2nO2 = 2nCO2 + nH2O + 3nNa2CO3
=> nO2 = 0,52 mol
Bảo toàn khối lượng : mV + mO2 = mCO2 + mNa2CO3 + mH2O
=> mV = 15,2g
- Gọi công thức tổng quát của các muối trong V là CxH2x+1COONa ; CyH2y-1COONa
(y chẵn, x > 0)
-Phản ứng cháy : CxH2x+1COONa + O2 → (x + 0,5)CO2 + (x + 0,5)H2O + 0,5Na2CO3
Mol p
CyH2y-1COONa + O2 → (y + 0,5)CO2 + (y - 0,5)H2O + 0,5Na2CO3
Mol q
=> nCO2 – nH2O = q = 0,4 – 0,32 = 0,08 mol => p = 0,16 – q = 0,08 mol
Ta có : nC(V) = nCO2 + nNa2CO3 = 0,48 mol = 0,08.(x+1) + 0,08(y+1)
=> x + y = 4
Vì X có gốc hidrocacbon mạch nhánh, có 1 liên kết pi trong gốc hidrocacbon
=> số C trong gốc hidrocacbon của X ≥ 3
=> y = 3 và x = 1 thỏa mãn điều kiện
=> X là C3H5COOH, 2 axit còn lại là HCOOH và C2H5COOH với số mol bằng nhau = 0,04 mol
(Vì : Số C trung bình = 1 = ½ (tổng số C của 2 axit) => tỉ lệ mol 1 : 1)
Vậy Trong M có : 0,04 mol este E(gốc ancol là R) và 0,04 mol X
=> mM = 13,2 = 0,04.(R + 203) + 0,04.86 => R = 41 (C3H5)
=> %mE(M) = 73,94%
Đáp án cần chọn là: C

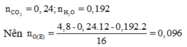
Vì X và Y đơn chức nên E là este đơn chức.
Suy ra E có 2 nguyên tử O trong phân tử.
Do đó nE = 1 2 nO(E) =0,048
⇒ ME = 4 , 8 0 , 048 = 100 là C5H8O2
Khi cho E tác dụng với dung dịch NaOH thì
nE =0,15; nNaOH =0,195⇒ n N a O H d - = 0 , 045 n m u ố i = 0 , 15
Nên mmuối + mNaOH dư = 14,1 ⇔ mmuối = 12,3
⇒ Mmuối = 12 , 3 0 , 15 = 82 là CH3COONa
Do đó Y là CH2=CHCH2OH.
Đáp án A

Chọn C.
Chất rắn khan là Na2CO3, NaCl với
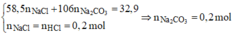
Xét phản ứng cháy của ancol:
Đặt 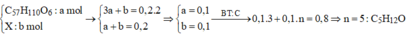
Hỗn hợp muối gồm C17H35COONa (0,3); CmH2m – 1O2Na (0,1).
Khi đốt cháy hỗn hợp muối thì thu được
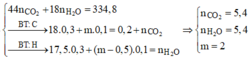
Vậy X là CH3COOC5H11 có 14 nguyên tử H.
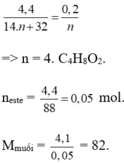
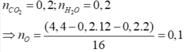
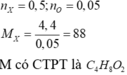
Đáp án B
CnH2nO2 → nCO2.
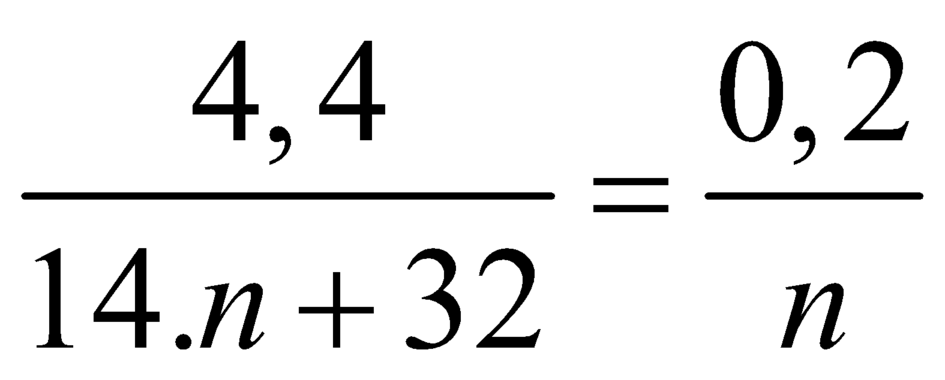
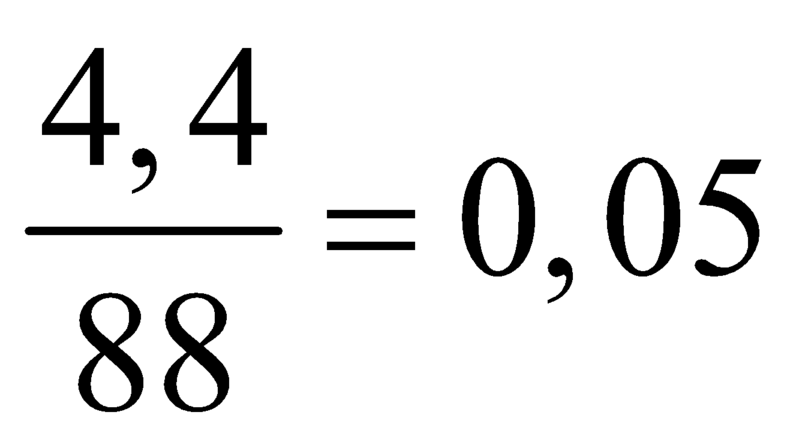 mol.
mol.
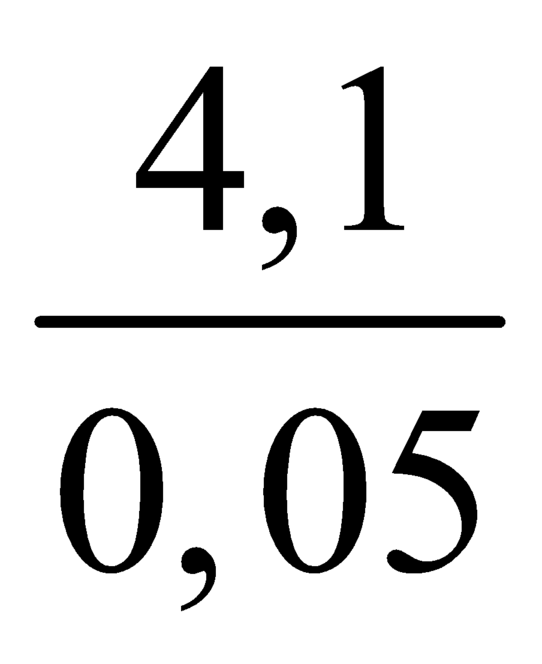 = 82. =>CH3COONa.
= 82. =>CH3COONa.
=> n = 4. C4H8O2.
neste =
Mmuối =
=> CH3COOC2H5.