Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

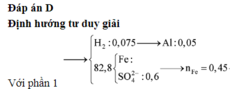
Xét phần 1: do sinh ra H2 ⇒ Al dư. nH2 = 0,075 mol ⇒ nAl dư = 0,05 mol.
Rắn không tan là Fe. Ta có: 2H2SO4 + 2e → SO2 + SO42– + 2H2O.
⇒ nSO42– = nSO2 = 0,6 mol ⇒ nFe = (82,8 – 0,6 × 96) ÷ 56 = 0,45 mol.
8Al + 3Fe3O4 → 4Al2O3 + 9Fe ⇒ nAl2O3 = 0,45 × 4 ÷ 9 = 0,2 mol.
⇒ mphần 1 = 0,05 × 27 + 0,2 × 102 + 0,45 × 56 = 46,95(g) ⇒ m phần 2 = 187,8(g).
⇒ phần 2 gấp 4 lần phần 1 ⇒ phần 2 chứa 0,2 mol Al; 0,8 mol Al2O3; 1,8 mol Fe.
Ta có: nH+ = 4nNO + 2nNO2 + 2nO + 10nNH4+ ⇒ nNH4+ = 0,015 mol.
Đặt nFe(NO3)2 = b ⇒ a + b = nFe = 1,8 mol; Bảo toàn electron:
0,2 × 3 + 3a + 2b = 1,25 × 3 + 1,51 + 0,015 × 8. Giải hệ có: a = 1,18.
Đáp án D

Đáp án C
· 1 2 X chứa 0,01 mol Cr2O3, 0,02 mol Al.
· Phần 1: + H2SO4 ® 0,04 mol SO2
Có 2 n SO 2 = 0 , 08 mol > 3 . n Al = 0 , 06 mol
Þ Chứng tỏ oxit sắt là FeO hoặc Fe3O4: n oxit Fe = 0 , 08 - 0 , 06 = 0 , 02 mol
· Phần 2: + vừa đủ 0,25 mol HCl ® 0,015 mol H2
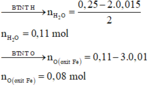
Þ Số nguyên tử O trong oxit Fe = 0 , 08 0 , 02 = 4
Þ Oxit sắt là Fe3O4.
· Sau phản ứng với NaOH dung dịch chứa: Na+ (x mol), Cl- (0,25 mol), AlO 2 - (0,02 mol), CrO 2 - (a mol).
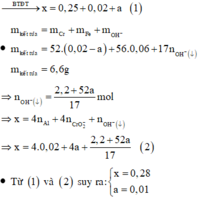
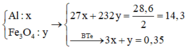
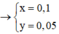
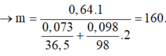

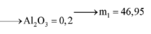
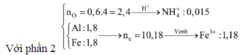


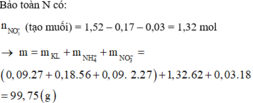
Coi hỗn hợp X ban đầu cũng như hỗn hợp Y gồm a mol Al và 3b mol Fe, 4b mol O.
Ở mỗi phần có nAl = 0,5a = nNaOH = 0,05 nên a = 0,1.
Áp dụng định luật bảo toàn mol electron cho phần 2 có:
hay 4,5b + 1,5a = 4b + 0,165 ⇒ b = 0,03.
Vậy m = mFe +mO + mAl = 9,66 (gam)
Đáp án C