K
Khách
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.
Các câu hỏi dưới đây có thể giống với câu hỏi trên

30 tháng 6 2019
Chọn đáp án D
Xét phần 1: do sinh ra H2 ⇒ Al dư. nH2 = 0,075 mol ⇒ nAl dư = 0,05 mol.
Rắn không tan là Fe. Ta có: 2H2SO4 + 2e → SO2 + SO42– + 2H2O.
⇒ nSO42– = nSO2 = 0,6 mol ⇒ nFe = (82,8 – 0,6 × 96) ÷ 56 = 0,45 mol.
8Al + 3Fe3O4 → 4Al2O3 + 9Fe ⇒ nAl2O3 = 0,45 × 4 ÷ 9 = 0,2 mol.
⇒ mphần 1 = 0,05 × 27 + 0,2 × 102 + 0,45 × 56 = 46,95(g) ⇒ m phần 2 = 187,8(g).
⇒ phần 2 gấp 4 lần phần 1 ⇒ phần 2 chứa 0,2 mol Al; 0,8 mol Al2O3; 1,8 mol Fe.
Ta có: nH+ = 4nNO + 2nNO2 + 2nO + 10nNH4+ ⇒ nNH4+ = 0,015 mol.
Đặt nFe(NO3)2 = b ⇒ a + b = nFe = 1,8 mol; Bảo toàn electron:
0,2 × 3 + 3a + 2b = 1,25 × 3 + 1,51 + 0,015 × 8. Giải hệ có: a = 1,18



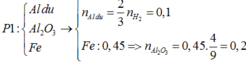
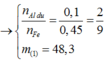
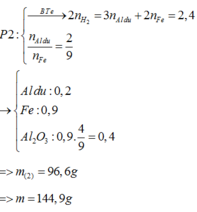

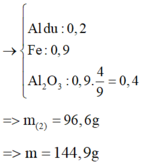




Chọn đáp án B
► Xét phần 1: Y + NaOH → H2. Mặt khác, phản ứng xảy ra hoàn toàn ⇒ Al dư.
nAl dư = 0,15 ÷ 1,5 = 0,1 mol. Phần không tan T là Fe ⇒ nFe = nH2 = 0,45 mol.
Lần lượt bảo toàn nguyên tố Oxi và Fe ⇒ nAl2O3 = 0,2 mol.
● GIẢ SỬ phần 1 tác dụng với HCl thì nH2 = 0,1 × 1,5 + 0,45 = 0,6 mol.
||⇒ phần 2 gấp 1,2 ÷ 0,6 = 2 lần phần 1 ⇒ lượng ban đầu gấp 3 lần phần 1.
► m = 3 × (0,1 × 27 + 0,2 × 102 + 0,45 × 56) = 144,9(g) ⇒ chọn B.