Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Bạn bấn vào đây, có người hỏi bài này rồi nhá Câu hỏi của Mạc Nhược Ca - Hóa học lớp 12 | Học trực tuyến

Xem hỗn hợp ban đầu được tạo thành từ: Fe, Cu và O2
Fe -------> Fe3+ + 3e
x.........................3x
Cu -------> Cu2+ + 2e
y..........................2y
O2 + 4e -----> 2O2-
z.........4z
S+6 + 2e -------> S+4
...........0,045..........0,0225
Gọi x, y, z là số mol Fe, Cu, O2. Ta có hệ gồm 3 pt:
56x + 64y + 32z = 2,44
3x + 2y = 4z + 0,045
0,5*400x + 160y = 6,6
=> x = 0,025, y = 0,01, z = 0,0125
=> %mCu = 0,01*64/2,44*100% = 26,23%

Bài 1:
A + Cl2 → ACl2 (1)
Fe + ACl2 → FeCl2 + A (2)
x x x (mol)
gọi số mol của Fe phản ứng với một số mol của ACl2 là x
khối lương thanh sắt sau phản ứng là:11,2 - 56x + xMA = 12
=> x =
Ta có:
= 0,25.0,4 = 0,1 (mol)
=> MA = 64 g/mol; Vậy kim loại A là Cu
= nCu =
= 0,2 (mol) =>
= 0,5M
bài 2:
(C17H35COO)3C3H5 + 3NaOH -> 3 C17H35COONa + C3H5(OH)3
890 kg 918 kg
x kg 720 kg
=> x = 698,04 kg.

nCu = 0,02; nAg = 0,005 → Tổng số mol e cho tối đa: = 0,02.2 + 0,005.1 = 0,45
nH+ = 0,09; nNO3- = 0,06 (dư)
4H+ + NO3- + 3e → NO + 2H2O
0,06 0,045 0,015
Cu, Ag đã phản ứng hết
2NO + O2 → 2NO2
0,015 0,0075 0,015
4NO2 + O2 + 2H2O → 4HNO3
0,015 0,015
Nồng độ mol HNO3 = 0,015:0,15 = 0,1 → pH = 1

Gọi a và b lần lượt là số mol của nhôm và của nhôm nitrat.
mX=mnhôm nitrat ⇔ 27a+213b=\(\dfrac{a+b}{2}\).102 ⇔ b=\(\dfrac{4}{27}\)a.
BTe: 3nnhôm=3nNO=3.0,81 ⇒ nnhôm=a=0,81 mol ⇒ b=nnhôm nitrat=0,12 mol.
Rắn khan trong Y chỉ chứa Al(NO3)3 (0,81+0,12=0,93 (mol)) với khối lượng là 0,93.213=198,09 (g).
Chọn B.

Đáp án C
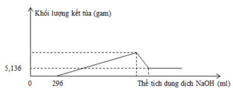
Quan sát đồ thị ta thấy:
mFe(OH)3 = 5,236 gam => nFe(OH)3 = 0,048 mol
nHNO3 dư = 0,296 mol => nHNO3 pư = 0,8 – 0,296 = 0,504 mol
Phần 1: Cho X tác dụng với H2SO4 đặc cũng như cho hỗn hợp đầu tác dụng
BT e: 3nAl = 2nSO2 => nAl = 2.0,09/3 = 0,06 mol
Phần 2: Cho X tác dụng với HNO3 cũng như cho hỗn hợp đầu tác dụng
Al + 4HNO3 → Al(NO3)3 + NO + 2H2O
0,06→0,24
Fe2O3 + 6HNO3 → 2Fe(NO3)3 + 3H2O
0,024←0,144←0,048
Fe2O3 + 6HNO3 → 2Fe(NO3)3 + 3H2O
0,02 ←0,504-0,24-0,144 = 0,12
mCr2O3 (1 phần) = 0,02.152 = 3,04 gam
=> mCr2O3 = 6,08 gam
 với các chất sau:
với các chất sau: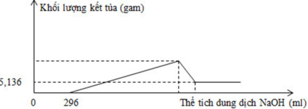
Quan sát đồ thị ta thấy:
mFe(OH)3 = 5,236 gam => nFe(OH)3 = 0,048 mol
nHNO3 dư = 0,296 mol => nHNO3 pư = 0,8 – 0,296 = 0,504 mol
Phần 1: Cho X tác dụng với H2SO4 đặc cũng như cho hỗn hợp đầu tác dụng
BT e: 3nAl = 2nSO2 => nAl = 2.0,09/3 = 0,06 mol
Phần 2: Cho X tác dụng với HNO3 cũng như cho hỗn hợp đầu tác dụng
Al + 4HNO3 → Al(NO3)3 + NO + 2H2O
0,06→0,24
Fe2O3 + 6HNO3 → 2Fe(NO3)3 + 3H2O
Fe dư + HNO3 => Chỉ tạo ra được muối sắt(II)
Fe + 4HNO3 → Fe(NO3)3 + NO↑ + 2H2O
Fe + 2Fe(NO3)3 → 3Fe(NO3)2
Dùng Fe để điều chế Cu từ CuSO4 theo phương pháp thủy luyện
Fe + CuSO4 → FeSO4 + Cu↓
0,024←0,144←0,048
Fe2O3 + 6HNO3 → 2Fe(NO3)3 + 3H2O
0,02 ←0,504-0,24-0,144 = 0,12
mCr2O3 (1 phần) = 0,02.152 = 3,04 gam
=> mCr2O3 = 6,08 gam
Đáp án C