Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

PTHH : CO2 + Ca(OH)2 ----> CaCO3 + H2O (1)
CO2 + CaCO3 + H2O ----> Ca(HCO3)2 (2)
nCa(OH)2 = 0,2 (mol)
+Xét nCO2 = 0,25 (mol). Vì nCO2 > n Ca(OH)2
=> xảy ra (1) và (2)
Có : nCO2 = 2nCa(OH)2 - n(kt)
=> 0,25 = 2.0,2 - n(kt)
=> n(kt) = 0,15 (mol)
=> m = 15 (g)
+Xét nCO2 = 0,35 (mol).Vì nCO2 > nCa(OH)2
=> xảy ra (1) và (2)
Có : nCO2 = 2nCa(OH)2 - n(kt)
=> 0,35 = 0,2.2 - n(kt)
=> n(kt) = 0,05 (mol)
=> m = 5 (g)
Vậy m biến đổi trong khoảng \(5\le m\le15\)
=> B

Đáp án B
Ta có: n B a ( O H ) 2 = 0,12 mol; n C O 2 = 0,1 mol ; n C O 2 = 0,2 mol
-Tại điểm cực đại:
CO2+ Ba(OH)2 → BaCO3+ H2O
0,12 0,12 0,12
Vậy khi n C O 2 = 0,12 mol thì lượng kết tủa đạt cực đại
Vậy khi đi từ n C O 2 = 0,1 mol đến 0,12 mol thì lượng kết tủa sẽ dần tăng lên. Khi đi từ n C O 2 = 0,12mol đến 0,2 mol thì lượng kết tủa sẽ dần giảm xuống
→Lượng kết tủa nhỏ nhất khi n C O 2 = 0,1 mol hoặc 0,2 mol.
-Khi n C O 2 = 0,1 mol
CO2+ Ba(OH)2 → BaCO3+ H2O
0,10 0,10 0,10 mol
Ta có: n B a C O 3 = 0,1 mol
-Khi n C O 2 = 0,2 mol
CO2+ Ba(OH)2 → BaCO3+ H2O
x x x mol
2CO2 + Ba(OH)2 → Ba(HCO3)2
2y y mol
Ta có: n B a ( O H ) 2 = x + y = 0,12 mol ; n C O 2 = x+ 2y = 0,2 mol
→ x = 0,04 mol ; y = 0,08 mol
Ta có: n B a C O 3 = 0,04 mol
So sánh 2 trường hợp trên ta thấy n B a C O 3 m i n = 0,04 mol → m B a C O 3 m i n = 7,88 gam

Chọn B
\(n_{OH^-}=0,24\left(mol\right)\)
\(n_{Ca^{2+}}=0,1\left(mol\right)\)
Khi số mol CO2 biến đổi từ 0,08 mol đến 0,2 mol thì \(\dfrac{n_{OH^-}}{n_{CO_2}}>1\) nên chỉ tạo ra muối trung hòa.
Khi số mol CO2 = 0,08 thì \(n_{CO_2}< n_{Ca^{2+}}\) => Bảo toàn Cacbon\(\Rightarrow n_{CaCO_3}=0,08.\left(40+12+16.3\right)=8\left(g\right)\)
Khi số mol CO2 = 0,2 mol thì \(n_{CO_2}>n_{Ca^{2+}}\) => Bảo toàn Ca
\(\Rightarrow m_{CaCO_3}=0,1.\left(40+12+16.3\right)=10\left(g\right)\)

n H + = 2 n H 2 S O 4 = 0 , 15 . 2 = 0 , 3 ; n S O 4 2 - = 0 , 15 v à n C O 3 2 - = 0 , 1 ; n H C O 3 - = 0 , 3
Xác định tỉ lệ số mol của C O 3 2 - v à H C O 3 - và trong dung dịch ta có:
n N a 2 C O 3 n N a H C O 3 = 0 , 1 0 , 3 = 1 3
So sánh số mol: Ta có: ( 2 n C O 3 2 - + n H C O 3 2 - ) = 0 , 5 > n H + = 0 , 3 ⇒ H + h ế t
Khi cho từ từ A vào B nên C O 3 2 - và H C O 3 - sẽ đồng thời phản ứng với axit.
Vì vậy giả sử nếu C O 3 2 - phản ứng hết x mol thì H C O 3 - sẽ phản ứng 1 lượng đúng bằng tỉ lệ mol trong dung dịch của 2 chất là 3x mol.
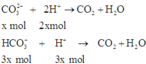
Do H+ hết nên tính theo H+ ta có: 5x = 0,3 ⇒ x = 0,6
⇒ Trong X chứa anion: H C O 3 - (0,3 – 3.0,6 = 0,12 mol), C O 3 2 - (0,1 – 0,06 = 0,04 mol) và S O 4 2 - (0,15 mol)
Khi cho Ba(OH)2 dư vào ta có các phản ứng:
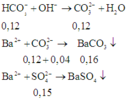
Vậy khối lượng kết tủa thu được là:
![]()

Đáp án A
Nhỏ từ từ H2SO4 vào dd X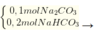 ddY + 0,2 mol CO2.
ddY + 0,2 mol CO2.
ddY + Ba(OH)2 dư → m↓ = ? gam
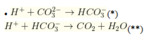
Theo (*) ![]()
Theo (**) ![]()
Dung dịch X gồm H C O 3 - dư 0,1 mol; H2SO4 0,15 mol.
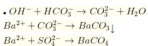
nBaCO3 = 0,1 mol; nBaSO4 = 0,15 mol
→ m↓ = mBaCO3 + mBaSO4 = 0,1 × 197 + 0,15 × 233 = 54,65 gam → Đáp án đúng là đáp án A

Đáp án A
nOH- = 0,1.2 + 0,225 + 0,2 = 0,625 mol
Do nH+>nCO2 nên X có cả CO32- => X không có Ba2+ => nBaCO3 = 0,1 mol
Đặt x, y là số mol CO32- và số mol HCO3- phản ứng với H+
x+y = nCO2 = 0,25
2x+y = nH+ = 0,35
=> x = 0,1; y = 0,15
Dung dịch X chứa: K+ (0,225 mol), Na+ (0,2 mol), CO32- (0,1k mol), HCO3- (0,15k mol)
BTĐT: 0,225 + 0,2 = 2.0,1k + 0,15k => k = 1,3
BTNT C: nCO2 ban đầu = nBaCO3 + nCO32- + nHCO3- = 0,1 + 0,13 + 0,195 = 0,425 mol
=> V = 9,52 lít

Đáp án C
Trường hợp 1: Thí nghiệm ban đầu chưa có phản ứng hòa tan một phần kết tủa
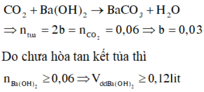
Trường hợp 2: Thí nghiệm ban đầu đã có phản ứng hòa tan hoàn toàn kết tủa
Áp dụng công thức giải nhanh
Thí nghiệm 1 có 2b = 0,5V - 0,06
Thí nghiệm 2 có b = 0,5V - 0,08
![]()


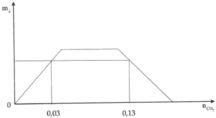

Xét \(T=\dfrac{n_{CO2}}{n_{Ba\left(OH\right)2}}\)
TH1. \(T\le1\Rightarrow n_{CO2}\le0,02mol\): sp là muối BaCO3.
TH2. \(1< T< 2\Rightarrow0,02< n_{CO2}< 0,04\): sp tạo thành gồm BaCO3 và Ba(HCO3)2.
TH3. \(T\ge2\Rightarrow n_{CO2}\ge0,04mol\): sp là muối Ba(HCO3)2.
Vì nCO2 biến thiên trong khoảng 0,005mol đến 0,024mol.
=> Xảy ra TH1 và TH2.
- Nếu nCO2 biến thiên từ 0,05mol đến 0,2mol
nBaCO3=nCO2 (Em viết PTHH sẽ thấy rõ).
- Nếu nCO2 biến thiên từ 0,2mol đến 0,024mol
nBaCO3 =nCO3= nOH-nCO2=2nBa(OH)2-nCO2 (Công thức giải nhanh áp dụng cho TH sản phẩm tạo thành chứa 2 muối nCO3= nOH-nCO2 )
Bảng giá trị.